
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Расчет объемов продуктов сгорания топлива
Рассчитаем объемы продуктов сгорания для случая, когда полное сгорание топлива осуществляется при минимально возможном количестве воздуха, то есть теоретически необходимом количестве  или
или  . Образующийся в этом случае объем газов называют теоретическим объемом продуктов сгорания.
. Образующийся в этом случае объем газов называют теоретическим объемом продуктов сгорания.
Возьмем 1 кг топлива, состав которого задан рабочей массой Ср, Нр, Sp, Np, Ор, Ар и Wр в процентах. В случае полного сгорания 1 кг топлива при теоретически необходимом количестве воздуха в продуктах сгорания за счет полного сгорания горючих элементов Ср, Sp, Hp и испарения влаги топлива Wp и воздуха образуются трехатомные газы СО2, SO2, H2O и азот N2.
Последний поступает в продукты сгорания из воздуха и топлива (кислорода О2 в продуктах сгорания нет, так как он полностью израсходован на окисление горючих элементов). Рассчитаем теоретические объемы СО2, SO2, Н2О и N2.
Расчет теоретического объема углекислого газа  . Для этого воспользуемся формулой горения углерода (2.5). Из нее следует, что при сгорании 12 кг углерода образуется 44 кг углекислого газа. Следовательно, при сгорании 1 кг углерода образуется 44/12=11/3 кг СО2. В 1 кг топлива содержится Ср/100 кг углерода; поэтому при их сжигании углекислого газа образуется, кг/кг,
. Для этого воспользуемся формулой горения углерода (2.5). Из нее следует, что при сгорании 12 кг углерода образуется 44 кг углекислого газа. Следовательно, при сгорании 1 кг углерода образуется 44/12=11/3 кг СО2. В 1 кг топлива содержится Ср/100 кг углерода; поэтому при их сжигании углекислого газа образуется, кг/кг,
 . .
|
Объем СО2 равен его массе, деленной на его плотность  = 1,97 кг/м3. Теоретический объем
= 1,97 кг/м3. Теоретический объем  будет равен, м3/кг,
будет равен, м3/кг,
 . .
| (2.12) |
Расчет теоретического объема сернистого ангидрида  . Для этого воспользуемся формулой горения серы (2.9). Из нее следует, что при горении 32 кг серы образуется 64 кг сернистого ангидрида SO2. Таким образом, при сгорании 1 кг серы образуется 64/32 = 2 кг SO2. В 1 кг топлива содержится
. Для этого воспользуемся формулой горения серы (2.9). Из нее следует, что при горении 32 кг серы образуется 64 кг сернистого ангидрида SO2. Таким образом, при сгорании 1 кг серы образуется 64/32 = 2 кг SO2. В 1 кг топлива содержится  /100 кг серы, следовательно, при сгорании образуется SO2, кг/кг,
/100 кг серы, следовательно, при сгорании образуется SO2, кг/кг,
 . .
|
Теоретический объем  , м3/кг, будет равен
, м3/кг, будет равен
 , ,
| (2.13) |
| где | 
| – | плотность SO2 при нормальных условиях. |
Сумму газов СО2 и SO2 называют сухим трехатомным газом и обозначают RO2, то есть RO2 = СО2 + SO2. Тогда теоретический объем сухих трехатомных газов, м3/кг, будет составлять
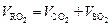 . .
| (2.14) |
Теоретический объем 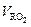 не зависит от количества подаваемого для горения воздуха, поэтому здесь индекс «0» можно опустить.
не зависит от количества подаваемого для горения воздуха, поэтому здесь индекс «0» можно опустить.
Расчет теоретического объема водяных паров 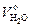 . Водяные пары образуются в продуктах сгорания за счет горения водорода топлива
. Водяные пары образуются в продуктах сгорания за счет горения водорода топлива  за счет испарения влаги, содержащейся в топливе
за счет испарения влаги, содержащейся в топливе  и влаги, вносимой влажным воздухом
и влаги, вносимой влажным воздухом  , а также за счет использования пара при распиливании топлива паромеханическими форсунками
, а также за счет использования пара при распиливании топлива паромеханическими форсунками 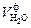 . Следовательно, для теоретического объема водяного пара можно записать
. Следовательно, для теоретического объема водяного пара можно записать
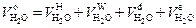 . .
| (2.15) |
Рассчитаем величины, входящие в правую часть формулы (2.15). Из формулы горения водорода (2.7) следует, что при сгорании 1 кг водорода образуется 18/2 или 9 кг водяных паров. В топливе массой 1 кг содержится Нр/100 кг водорода, поэтому при его сгорании образуется 9Нр/100 кг водяных паров, а их объем будет равен, м3/кг,
 , ,
| (2.16) |
| где | 
| – | условная плотность водяного пара при нормальных условиях; величина Нр выражена в процентах по массе. |
Объем водяного пара за счет испарения влаги топлива Wp, %, составит, м3/кг,
 . .
| (2.17) |
Расчет объема водяного пара  . Водяной пар поступает в продукты сгорания с влажным воздухом. Пусть влажность атмосферного воздуха равна d = 10 г/кг или 0,01 кг/кг. Следовательно, количество влаги, вносимой в продукты сгорания влажным воздухом, будет равно
. Водяной пар поступает в продукты сгорания с влажным воздухом. Пусть влажность атмосферного воздуха равна d = 10 г/кг или 0,01 кг/кг. Следовательно, количество влаги, вносимой в продукты сгорания влажным воздухом, будет равно 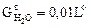 , кг/кг, где
, кг/кг, где 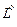 – теоретически необходимое количество сухого воздуха для сгорания 1 кг топлива, кг/кг. Объем водяного пара, образовавшегося из этой влаги, будет равен, м3/кг,
– теоретически необходимое количество сухого воздуха для сгорания 1 кг топлива, кг/кг. Объем водяного пара, образовавшегося из этой влаги, будет равен, м3/кг,
 . .
| (2.18) |
Поскольку 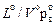 , то окончательно получаем объем водяных паров, вносимых воздухом, м3/кг,
, то окончательно получаем объем водяных паров, вносимых воздухом, м3/кг,
 . .
| (2.19) |
Объем водяного пара, вносимого паромеханическими форсунками, распыливающими топливо, равен, м3/кг,
 , ,
| (2.20) |
| где | 
| – | расход пара на распыливание топлива в паромеханических форсунках; обычно  = 0,01 ÷ 0,05 кг/кг. = 0,01 ÷ 0,05 кг/кг.
|
Окончательно теоретический объем водяных паров при сгорании 1 кг топлива будет равен сумме значений, определяемых формулами (2.16), (2.17), (2.19) и (2.20), м3/кг,
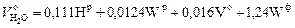 , ,
| (2.21) |
| Здесь величины |  и и 
| – в процентах по массе; |
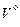
| – в м3/кг; | |

| – кг/кг. |
Расчет теоретического объема азота  . Азот поступает в продукты сгорания из воздуха и топлива. В воздухе находится азота 79% по объему, значит, его объем составит 0,79
. Азот поступает в продукты сгорания из воздуха и топлива. В воздухе находится азота 79% по объему, значит, его объем составит 0,79 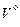 m3. В топливе азота содержится Np %. Объем этого азота равен Np/(100∙
m3. В топливе азота содержится Np %. Объем этого азота равен Np/(100∙  ), где
), где  кг/м3 – плотность азота при нормальных условиях.
кг/м3 – плотность азота при нормальных условиях.
Полный теоретический объем азота равен, м3/кг,
 . .
| (2.22) |
Суммарный теоретический объем продуктов сгорания, полученных при сжигании 1 кг топлива, равен, м3/кг,
 . .
| (2.23) |
Расчет действительного объема продуктов сгорания. В реальных условиях топливо сжигают не при теоретически необходимом количестве воздуха, а при действительно подаваемом количестве, которое больше теоретического.
Отношение действительного количества воздуха  , подводимого в топку для сгорания 1 кг топлива, к теоретически необходимому количеству
, подводимого в топку для сгорания 1 кг топлива, к теоретически необходимому количеству 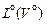 называется коэффициентом избытка воздуха
называется коэффициентом избытка воздуха  , то есть
, то есть
 или или  . .
| (2.24) |
Коэффициент избытка воздуха выбирают в зависимости от вида и свойств топлива, способа его сжигания, режима работы топки и других показателей. Для судовых паровых котлов на мазутном топливе при работе на полной нагрузке коэффициент избытка воздуха составляет 1,05–1,25.
При сжигании топлива при 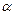 > 1 действительный объем продуктов сгорания будет больше теоретического на величину объема избыточного количества сухого воздуха (
> 1 действительный объем продуктов сгорания будет больше теоретического на величину объема избыточного количества сухого воздуха (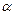 – 1)
– 1) 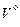 и объема водяных паров 0,0161 (
и объема водяных паров 0,0161 (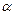 – 1)
– 1) 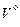 , содержащихся в избыточном воздухе. С учетом этого действительный объем продуктов сгорания при нормальных условиях будет равен, м3/кг,
, содержащихся в избыточном воздухе. С учетом этого действительный объем продуктов сгорания при нормальных условиях будет равен, м3/кг,
 . .
| (2.25) |
Не нашли, что искали? Воспользуйтесь поиском: