
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Закон эквивалентов.
В химических расчетах используется специфическая единица количества вещества – моль.
Моль( ν ) – количество вещества, содержащее столько структурных единиц (атомов, молекул, ионов), сколько атомов содержится в 12 г изотопа углерода 12С.
Один моль любого вещества содержит Na = 6,02·1023 молекул (Na - число Авогадро).
Молярная масса ( М ) – масса 1 моль вещества.
Молярную массу вещества легко сосчитать, если известна формула вещества, т.к. численно масса моля совпадает с молекулярной массой (Мr). Например, молярная масса азотной кислоты М(HNO3) = 63 г/моль.
Молярный объём 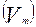 – объём одного моль газообразного вещества.
– объём одного моль газообразного вещества.
 Закон Авогадро: В равных объёмах любых газов при одинаковых температурах и давлении, содержится одинаковое число молекул.
Закон Авогадро: В равных объёмах любых газов при одинаковых температурах и давлении, содержится одинаковое число молекул.
При нормальных условиях (н.у.: температура 273 К, давление 101,325 кПа или 760 мм рт.ст.) для любого газа  = 22,4 л/моль.
= 22,4 л/моль.
Стехиометрические коэффициенты - числа, стоящие перед формулами веществ в уравнениях реакции.
Стехиометрические коэффициенты определяют соотношения количеств исходных веществ и продуктов реакции.
 Закон сохранения массы: Общая масса веществ, вступивших в реакцию, равна общей массе продуктов реакции.
Закон сохранения массы: Общая масса веществ, вступивших в реакцию, равна общей массе продуктов реакции.
Исходя из закона сохранения массы, можно составлять химические уравнения и по ним производить расчёты.
 Закон кратных отношений: Если два элемента образуют друг с другом несколько химических соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого элемента, относятся между собой как небольшие целые числа.
Закон кратных отношений: Если два элемента образуют друг с другом несколько химических соединений, то массы одного элемента, приходящиеся на одну и ту же массу другого элемента, относятся между собой как небольшие целые числа.
Математически этот закон может быть выражен соотношением:
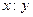 =
=  , (1.1.)
, (1.1.)
где Э1 и Э2 - атомы элементов, составляющих молекулу вещества;
х, у – число атомов каждого элемента в молекуле, соответственно;
А – атомные массы.
 Закон постоянства состава: Любое химическое соединений имеет один и тот же количественный и качественный состав независимо от способа его получения.
Закон постоянства состава: Любое химическое соединений имеет один и тот же количественный и качественный состав независимо от способа его получения.
Из закона постоянства состава следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях. Поэтому в химии введено понятие эквивалента.
Химический эквивалент ( n ) – количество вещества, химически равноценное (эквивалентное) 1 моль- иону или 1-моль-атому водорода.
Эквивалент водорода n(H) = 1 моль-экв.
Эквивалентная масса( Э ) – масса 1 моль-эквивалент вещества.
Эквивалентную массу рассчитывают по формулам:
 ; (1.2.)
; (1.2.)
 ; (1.3.)
; (1.3.)
 ; (1.4.)
; (1.4.)
 ; (1.5.)
; (1.5.)
 , (1.6.)
, (1.6.)
где М – молярная масса;
с.о. – степень окисления;
n  – число принятых (или отданных) электронов;
– число принятых (или отданных) электронов;
Σс.о. металла – суммарная степень окисления металла (степень окисления металла, умноженная на количество атомов металла в молекуле).
 Закон эквивалентов: массы реагирующих веществ прямо пропорциональны их эквивалентным массам:
Закон эквивалентов: массы реагирующих веществ прямо пропорциональны их эквивалентным массам:
 (1.7.)
(1.7.)
Не нашли, что искали? Воспользуйтесь поиском: