
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Катализ. Особенности гомогенного и гетерогенного катализа
Изменить скорость химической реакции можно с помощью катализаторов.
Катализаторы, ускоряющие реакцию, называются стимуляторами. Катализаторы противоположного действия называются ингибиторами.
Каталитическое воздействие может быть оказано на большинство химических реакций. Изменяя скорость химической реакции, сам катализатор в реакции не расходуется и в конечные продукты не входит.
Гомогенный (однородный) катализ: реагирующие вещества и катализатор образуют однофазную структуру, т. е. между катализатором и реагирующими веществами отсутствует поверхность раздела. Для этого типа катализа установлено, что скорость химической реакции пропорциональна концентрации катализатора. Например, каталитическое окисление сернистого газа в присутствии катализатора оксида азота (II):
NO(г)
SO2(г) + 1/2 О2(г) → SO3(г).
Данная реакция протекает в две стадии с участием катализатора:
1. Происходит окисление катализатора NO:
NO(г) + 1/2O2(г) → NO2(г)
2. NO вновь образуется в результате:
NO2(г) + SO2(г) → SO3(г) + NO(г).
Гетерогенный (неоднородный) катализ: между катализатором и реагирующими веществами существует поверхность раздела. Обычно катализатор – твердое вещества, а реагенты – газы или жидкости. В этом случае реакция протекает на поверхности катализатора. При этом активность твердого катализатора зависит от свойств его поверхности (строение, размер, химический состав). Примером такого катализа может быть также реакция окисления сернистого газа в присутствии твердого катализатора V2O5:
V2O5(тв)
SO2(г) + 1/2 О2(г) → SO3(г).
Механизм гетерогенного катализа можно объяснить тем, что поверхность катализатора неоднородна, на ней имеются так называемые активные центры, на которых адсорбируются молекулы реагирующих веществ. Под действием катализатора у таких молекул связи между атомами ослабляются, и через образование активных комплексов (поверхностных промежуточных соединений) происходит образование продуктов реакции:


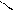

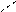

 O O О O O
O O О O O








 S + → S → S O + O
S + → S → S O + O
 O O O O O атом кислорода
O O O O O атом кислорода
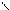 оксид серы (IV) молекула кислорода активный комплекс оксид серы (VI)
оксид серы (IV) молекула кислорода активный комплекс оксид серы (VI)
Не нашли, что искали? Воспользуйтесь поиском: