
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Степень диссоциации. Сильные и слабые электролиты
Процесс электролитической диссоциации обратимый, поэтому в растворе электролита, наряду с его ионами присутствуют и молекулы. Соотношение содержания этих частиц определяется степенью электролитической диссоциации, которая является количественной характеристикой процесса диссоциации.
Степень диссоциации (α) – это отношение числа молекул электролита, распавшихся на ионы ( n ) к общему числу растворенных молекул ( 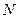 ):
):
 . (7.8)
. (7.8)
Степень диссоциации определяется опытным путем и выражается в долях единицы или в процентах:
 (7.9)
(7.9)
Если α = 0, то диссоциация отсутствует. Если α = 100%, то электролит полностью распадается на ионы. Если α = 1,3%, то из 1000 молекул электролита только 13 диссоциирует на ионы.
Факторы, влияющие на степень электролитической диссоциации:
1. Природа электролита: полярность химической связи в соединении, увеличение которой способствует возрастанию α.
2. Концентрация раствора: α возрастает с уменьшением концентрации раствора.
3. Температура: α увеличивается с повышением температуры раствора.
Все электролиты по значению степени электролитической диссоциации принято делить на 3 группы: сильные, слабые и средней силы (табл.7.1.).
При написании уравнений диссоциации следует учитывать силу электролита. Согласно теории электролитической диссоциации, сильные электролиты диссоциируют в одну стадию на ионы, из которых состоит молекула электролита. Например:
H2SO4 ↔ 2H+ + SO42-.
Слабые электролиты диссоциируют ступенчато, при этом преобладают ионы первой стадии (ступени). Например:
I ступень H2S ↔ H+ +НS-
II ступень HS- ↔ H+ + S2-.
В растворах слабых электролитов всегда имеет место химическое равновесие, выражающееся в равенстве скоростей реакции диссоциации и ассоциации. Используя закон действующих масс (6.8.), для таких электролитов равновесие количественно можно выразить величиной константы диссоциации (Кдисс)[‡]. Например, для электролита НА ↔ Н+ + А- константа диссоциации:
 . (7.10)
. (7.10)
Таблица 7.1.
Классификация электролитов в зависимости от величины α[§]
| Сильные, α >30% | Средней силы, 3<α<30% | Слабые, α < 3% |
| Вещества, которые при растворении практически полностью диссоциируют на ионы. Это: - почти все соли; - щелочи; - многие минеральные кислоты: HClO4, H2SO4, HMnO4, HNO3, HCl, HBr, HJ, HClO3. | Вещества, в растворах которых число диссоциирующих молекул примерно равно числу молекул, не подвергающихся диссоциации. Это небольшая группа: H3PO4, H2SO3, H2C2O4. | Вещества, при растворении в воде диссоциируют на ионы в незначительной степени. Это: - нерастворимые основания; -почти все органические кислоты и основания; -некоторые минеральные кислоты: H2CO3, H2S, HNO2,HF, HClO, H2SiO3, H3BO3, HCN; -NH4OH; - сама H2O. |
Ионные уравнения
Согласно теории электролитической диссоциации все реакции в водных растворах электролитов являются реакциями между ионами. Они называются ионными реакциями, а уравнения этих реакций – ионными уравнениями.
При изучении процессов, протекающих в растворах электролитов, следует руководствоваться правилом:
Реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов.
В ионных уравнениях принято записывать в недиссоциированной на ионы форме (в виде молекул) формулы трудно растворимых соединений, неэлекролитов, электролитов слабых и средней силы. Запись ионных реакций может быть представлена в виде молекулярного, полного и сокращенного ионного уравнений. При записи уравнения знак ↓, стоящий при формуле, означает, что вещество удаляется из сферы реакции в виде нерастворимого соединения, знак ↑ показывает, что вещество выделяется в виде газа.
Пример:
молекулярное уравнение BaCl2 + H2SO4 = BaSO4↓ + 2HCl
полное ионное уравнение Ba2+ + 2Cl- + 2H+ + SO42- = BaSO4↓ + 2H+ + 2Cl-
сокращенное ионное уравнение Ba2+ + SO42- = BaSO4↓.
При написании ионных уравнений пользуемся данными таблицы «Растворимости солей, кислот и оснований в воде» (Приложение, табл.4.).
Не нашли, что искали? Воспользуйтесь поиском: