
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Зависимость реакционной способности ГЦС
· Чем равномернее распределены электроны по системе, тем в большей степени связи в гетероцикле приближаются к бензольным (полуторным), тем выше ароматичность и тем ярче выражена устойчивость соединения к окислителям и восстановителям, тем в меньшей степени идут реакции присоединения и полимеризации и в большей - реакции замещения.
· Распределение электронного облака гетероцикла зависит от гетероатома: чем выше его электроотрицательность, тем больше требуется усилий на обобществление его электронной пары, тем менее равномерно распределено электронное облако по молекуле.
· Электроотрицательность гетероатомов изменяется в ряду: O>N>S>C. При этом атом серы имеет валентные электроны на 3p-орбиталях и свободные 3d-орбитали, которых нет у кислорода, азота и углерода. Это позволяет атому серы компенсировать свою электроотрицательность за счет индукционного эффекта и, в то же время, достаточно легко отдавать свои 3p-электроны на создание общего электронного облака.
· Наиболее легко обобществляются электроны атомов углерода и серы, затем азота и хуже всего у атома кислорода, и ароматичность гетероциклов уменьшается в ряду: бензол (150) > тиофен (130) > пиррол (110) > фуран (80)
· Азолы более ароматичны, чем пиррол и фуран. Объясняется это большей делокализацией электронной пары атомов серы, пиррольного азота или кислорода под влиянием пиридинового азота, электроотрицательность у которого выше, чем у атома углерода.
Синтез ГЦС
Синтез заключается в построении кольца, в отличие от производных бензольного типа. При этом возможны комбинации реагентов, по трем схемам, позволяющим конструировать пяти и шестичленные циклы, с одним и двумя гетероатомами:



По «схеме А» образуются две С – X связи, по «схеме Б» - C – X и C – Z связи, а по «схеме В» - одна C – X и одна С – С. Первая схема синтеза более универсальная, позволяет получать пяти- и шестичленные циклы с одним и двумя гетероатомами, вторая – гетероциклы только с двумя, а третья – только с одним гетероатомом
Реагентами синтезов по всем схемам являются 1,2-, 1,3- 1,4- и 1,5-дикарбонильные соединения либо соединения, содержащие в этих положениях другие активные функции (карбоксильную, сложноэфирную, амидную, циано, амино, галогены и др.). Один из реагентов в «схеме В» должен содержать нуклеофильный атом углерода или быть енамином.
Для синтеза азот- и серу-содержащих циклов дикарбонильные соединения обрабатывают аммиаком (аминами) или сульфидами фосфора или соединениями, содержащие два гетероатома (гидразин, гидроксиламин, тиоамиды и др.) («схема Б»). В синтезах конденсированных систем используют фенолы или ароматические амина. В одних случаях сразу получаются ароматические соединения, а в других – необходима ароматизация.
необходимо помнить, что 5- и 6-членные циклы очень устойчивы, и молекулы, стремясь перейти в более устойчивое соединение, часто самопроизвольно образуют циклическую форму.
Синтез ГЦ по «схеме А»
В синтезе используют субстраты от алканов до карбоновых кислот, но чаще всего применяют дикарбонильные соединения.
1. Циклизация 1,4-дикарбонильных соединений ( Синтезы Пааля-Кнорра ) является общим методом синтеза фурана, пиррола (в присутствии аммиака) и тиофена (в присутствии соединений серы):


Выходы целевых продуктов высокие (80-90%), за исключением тиофена. Считают, что P2S5 и P2S3 восстанавливают карбонильные соединения, поэтому выход составляет 40-50%.
1.1. Синтезы производных фурана из слизевой кислоты, пентоз и пентозанов являются разновидностью циклизации 1,4-дикарбонильных соединений, которые образуются по ходу реакции.


Фурфурол используется в промышленности как растворитель и как сырье для синтеза различных веществ, в том числе и лекарственных, например, фурацилин.

|
Фурацилин (семикарбазон, 5-нитро-2-фуранкарбальдегида или α-нитрофурфурола) - представитель группы бактерицидных препаратов, производных α-нитрофурана.
1.2. Синтезы пиррола и его производных из 1,4-бутиндиола и бутандиовых кислот так же разновидность циклизации 1,4-дикарбонильных соединений, которые образуются по ходу реакции:


1.3. В синтезах производных тиофена вместо 1,4-дикарбонильных соединений используют алканы, алкены, производные 1,3-бутадиина. Нуклеофильное присоединение по активированным π-связям приводит к образованию 1,4-тиокарбонильного соединения:

2. Взаимное превращение пятичленных гетероциклов с одним гетероатомом (реакция Юрьева) также можно отнести к схеме А, т.к. при этом образуются две новые связи С - Х:

3. Пирролидиновый цикл, который широко применяется в синтезах лекарств (например, пиромекаина, гигрония и др.), можно получить алкилированиемпервичного амина соответствующим дигалогенидом:
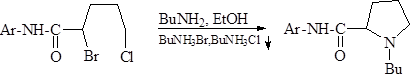
Не нашли, что искали? Воспользуйтесь поиском: