
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Практическая работа 1. Поглощение углекислого газа и выделение кислорода растениями при фотосинтезе.
Цель: рассмотреть процессы поглощения углекислого газа растениями и выделения ими кислорода при фотосинтезе.
Оборудование и реактивы: банка (1 л), воронка, газоотводная трубка, 3-4 ветки комнатного растения, источник света (настольная лампа), кристаллизатор, кусочек мрамора (мела), лучинка, пластилин, пробирки, гидрокарбонат натрия (5% - ный раствор), соляная кислота (1:1), спички,стакан,элодея.
Ход работы:
В литровую банку с притертой пробкой поместили 3-4 ветки комнатного растения (размером чуть меньше высоты банки) с большим количеством листьев. Банку с ветками заполнили водой, закрыли пробкой и опрокинули в кристаллизатор с водой. Пробку отвели в сторону, а в банку снизу подвели изогнутую стеклянную трубку.
Через трубку заполнили банку на 2/ 3 выдыхаемым воздухом или смесью газов, образующихся при сгорании угля, древесины, и на 1/3 углекислым газом, полученным действием кислоты на мрамор или мел. Вытеснив почти всю воду (для растения оставили слой воды 5 – 10 мм), вынули трубку, снова закрыли банку под водой пробкой, вынули из воды и поставили на стол.
С помощью зажжённой лучинки убедились, что в банке углекислый газ.
Банку закрытую притертой пробкой поставили на свет. При недостатке солнечного освещения использовали электрическое.
Результаты эксперимента.
Через 4 дня проверили наличие углекислого газа в банке с помощью зажженной лучинки.
Лучинка не гасла,как в начале опыта, а продолжала гореть.
Записать вывод к практической работе.
Выводы: Результаты эксперимента подтверждают то, что в процессе фотосинтеза растения поглощают углекислый газ и выделяют кислород.
Практическая работа 2. «Определение запыленности воздуха по листьям»
Эта работа проводится только в сухую ветреную погоду.
Цель: определить запыленность воздуха по листьям.
Оборудование: клейкая лента, весы, разновесы, цветные нитки.
По направлению розы ветров выберите на разном расстоянии от источника пылевого загрязнения, например дороги, деревья и кустарники с широкими листьями. Удалите пыль с листьев на нескольких ветках выбранного вами дерева и отметьте эти листья цветными нитками.
Наклейте на листья одинаковые квадраты липкой ленты, которые предварительно взвесьте.
Через неделю взвесьте квадраты липкой ленты с пылью. Разница масс покажет среднее значение запыленности воздуха в данном месте.
Сделайте вывод об уровне запыленности воздуха в исследованной вами местности.
Практическая работа 3. «Оценка загрязненности воздуха по состоянию хвои сосны»
Цель: определить загрязнение воздуха по состоянию хвои.
Выберите несколько молодых сосен и осмотрите их хвою на побегах предыдущего года. Определите класс повреждений и усыхания хвои. Учтите, что более светлый участок на концах хвоинок в оценку не включается.
| Класс поврежденности хвои | Класс усыхания хвои |
| 1 – хвоинки без пятен 2- хвоинки с небольшим числом мелких пятен 3 – хвоинки с многочисленными черными пятнами, мелкими и крупными | 1 - нет сухих участков 2 – усохли кончики хвоинок на 2-5 мм 3 – хвоинки усохли на треть длины 4 – все хвоинки желтые или более чем наполовину сухие |
Сделать вывод.
Тема 5. «Физические и химические свойства воды. Круговорот воды в природе»
Цель: Изучить свойства воды, круговорот воды в природе.
Задачи:
Предметные: познакомить учащихся со свойствами воды как химического вещества; формировать представления о важнейших классах неорганических соединений: кислотах и основаниях; учить учащихся записывать уравнения реакций
Метапредметные: создать условия для поиска взаимосвязи между новым и изученным материалом, развивая логическое мышление; активизировать познавательную деятельность школьников, развивая интереса к науке; формировать умение выделять главное, находить ответы на поставленные вопросы.
Личностные: воспитание положительной мотивации учения, интереса к знаниям, умения проводить самооценку; воспитывать чувство прекрасного.
Оборудование: компьютер, проектор, компьютерная презентация к уроку;
4 сосуда, 2 апельсина, картофель, железный противень, чашка Петри, кристаллизатор, фарфоровые чашки, пипетки.
Реактивы: натрий, вода, фенолфталеин, оксид кальция
Ход урока
Организационный момент: Ребята, наш урок мне хотелось бы начать с демонстрации эксперимента. Мне нужны 2 помощника. Есть желающие?
Эксперимент: 3 сосуда наполненных водой, в одном из сосудов не вода, а раствор соли.
2 ученика апельсин и мелкую картофелину опускают в 2 сосуда с водой (апельсин всплывает, а картофелина тонет). Учитель опускает мелкую картофелину в раствор соли (картофелина всплывает).
— Почему более тяжелый апельсин всплывает, а легкая картошка тонет?
— Может мне кто-то скажет, почему так происходит?
Учитель:
Причиной всему свойства загадочного и удивительного вещества имя которого – вода. Плюс маленькие химические хитрости, которые я использовала.
О Воде сложены былины и песни, её считают святой и живой, её уважают и почитают.
“Безбрежная ширь океана
И тихая заводь пруда,
Струя водопада и брызги фонтана,
И все это – только вода”.
Тучи, облака, туман, несущие влагу всему живому на земной поверхности, – это ведь тоже вода.
Бескрайние ледяные пустыни полярных областей, снежные покровы, застилающие почти половину планеты, – и это вода.
“В кружева будто одеты
Деревья, кусты, провода.
И кажется сказкою это,
А в сущности – только вода”.
Безгранично многообразие жизни. Она всюду на нашей планете. Но жизнь есть только там, где есть вода. Нет живого существа, если нет воды.
Вода – самая известная и самая загадочная из всех жидкостей, существующих на земле. Не случайно поэты посвящали ей удивительные строки.
Нам кажется, что мы все знаем о ней, но в то же время она таит в себе множество загадок и тайн.
Изучение нового материала: Сегодня на уроке мы будем их раскрывать, изучая свойства воды.
Тема урока: Вода, её физические и химические свойства. Круговорот воды в природе.
1. Физические свойства воды, особенные свойства воды
— Скажите, что представляет собой вода?
(жидкость, без цвета и запаха)
— При какой температуре вода закипает?
— При какой температуре вода замерзает?
Учитель:
Итак, вода – это жидкость, не имеющая цвета и запаха. Кипит при температуре 1000С, замерзает при 00С
— Вспомните из курса физики плотность воды? (плотность – 1г/см3)
— Ребята, скажите, почему лед – твердая вода не тонет в жидкой воде?
(Твердая вода – лед имеет меньшую плотность = 0,9г/см3 и при плавлении плотность воды не уменьшается как у всех веществ, а наоборот увеличивается).
Учитель: Это особенность воды!
При нагревании от 0 °C до + 4 °C (точнее, 3,98 °C) вода сжимается.
Соответственно, при остывании – её плотность падает. Когда температура опускается ниже 4 °C, то более холодная вода, т.к. менее плотная, остаётся на поверхности и замерзает, таким образом, подо льдом сохраняется положительная температура.
И хотя зимой поверхность водоема скована льдом, на дне водоема температура всегда равна 4°С. Это свойство воды позволяет рыбе зимовать в замерзших водоемах, прудах и озерах.
Другая особенность воды – это ее большая теплоемкость.
(Это количество теплоты, необходимое для нагревания 1 моль вещества).
Благодаря этому вода медленно нагревается и медленно остывает. Т.о. водные бассейны регулируют температуру на нашей планете.
Земля давно бы остыла и превратилась в безжизненный камень, если бы не вода, которая поглощает и возвращает очень много тепла, тем самым “выравнивает” климат.
— Ребята, в древности воду называли оборотень? Почему?
(вода может находиться в трех агрегатных состояниях)
Да, верно, еще древнегреческий философ Фалес Милетский говорил, что вода “единственное на земле вещество, встречающееся одновременно в трех состояниях – твердом, жидком и газообразном”.
В газообразном состоянии вода находится в атмосфере, в жидком и твердом – в гидросфере.
Практическая работа «Химические свойства воды»
Мы рассмотрели физические свойства воды. Теперь давайте познакомимся с некоторыми ее химическими свойствами. Т.е. теми свойствами, которые она проявляет при взаимодействии с другими веществами.
Запишите себе в тетрадь “Химические свойства воды”
Реагирует с металлами
А) с активными металлами (Ме 1-а группы) при этом образуется гидроксид металла и выделяется водород
Демонстрация опыта натрия с водой
2Na + 2H2O = 2NaOH + H2
Са + 2Н2О = Са(ОН)2 + H2
Б) Вода реагирует с менее активными металлами, стоящими в ряду напряжения до водорода. Образуется оксид металла и водород.
Zn + H2O = ZnO + H2
Практическая работа “Взаимодействие оксида кальция с водой”
Задание: В фарфоровую чашку насыпьте 1 г. Белого порошка оксида кальция и осторожно прилейте к нему 5-10 мл воды. Что наблюдаете? С помощью лакмусовой бумажки определите среду получившегося раствора. Запишите уравнение реакции, наблюдения и свои выводы в рабочую тетрадь.
СаО + Н2О = Са(ОН)2
На основании изученных свойств воды давайте сделаем вывод – активное ли вещество вода.
(Вода – активное вещество, т.к. вступает в реакции со многими веществами)
3. Круговорот воды в природе
Мы с вами свойства воды физические и химические. Нам осталось изучить круговорот воды в природе.
Я прочту вам сказку “Вода”, которую написал Леонардо да Винчи:
“Вода весело плескалась в родной морской стихии. Но однажды ей взбрела в голову шальная мысль добраться до самого неба. Она обратилась за помощью к огню. Своим обжигающим пламенем он обратил воду в мельчайшие капельки теплого пара, которые оказались гораздо легче воздуха.
Пар тот час устремился вверх, поднимаясь в самые высокие и холодные слои воздуха.
Оказавшись в заоблачной выси, капельки пара окоченели так, что у них зуб на зуб не попадал от холода. Чтобы согреться, они тесно прижались друг другу, став немного тяжелее воздуха, тут же попадали на землю в виде обычного дождя.
Заболев тщеславием, вода вознеслась к небу, но была изгнана оттуда.
Жаждущая земля поглотила дождь до единой капельки. И воде еще долго пришлось отбывать наказание в почве, прежде чем она, смогла возвратиться в морские просторы”.
Догадались ли вы, какие природные явления описал Леонардо да Винчи?
Давайте посмотрим, как это происходит в природе.
(ДЕМОНСТРАЦИЯ опыта “Делаем облако”)
Посмотрите, что происходит.
Практическая работа “Делаем облако”
Налейте в трехлитровую банку горячей воды (примерно 2,5 см.). Положите на противень несколько кубиков льда и поставьте его на банку.
Воздух внутри банки, поднимаясь вверх, станет охлаждаться. Содержащийся в нем водяной пар будет конденсироваться, образуя облако.
Этот эксперимент моделирует процесс формирования облаков при охлаждении теплого воздуха. И выпадение дождя.
— Кто мне скажет, откуда берется дождь?
— Почему вода в виде дождя падает на землю?
(Оказывается, капли, нагревшись на земле, поднимаются вверх. Там им становится холодно, они жмутся друг к другу, образуя облака.
Встречаясь вместе, они увеличиваются, становятся тяжелыми и падают на землю в виде дождя.)
— Какой процесс происходит при нагревании воды? (испарение)
— Какой процесс происходит при охлаждении воды? (конденсация)
— Какие это явления физические или химические? Почему?
Рефлексия:
Мы с вами разобрали все вопросы.
Давайте, так же как вода делает определенный круг, так и мы давайте вернемся к началу урока, к одному из наших действующих лиц — апельсину. (ДОСТАТЬ АПЕЛЬСИН). Он поможет нам подвести итог.
Беря в руки апельсин и передавая его друг другу, ответьте, пожалуйста, на вопрос:
— Что я узнал сегодня на уроке?
СПАСИБО
Итог урока:
(На доске нарисована колба. На столах у учащихся заготовки – капельки воды 2 цветов – голубого и серого)
Ребята, давайте с Вами наполним сосуд с водой!
Если урок вызвал у Вас хорошее настроение, понравился Вам, вы узнали для себя что-то новое. Поместите капельку голубого цвета – каплю чистой воды в сосуд.
Если урок не понравился, то поместите в сосуд каплю серого цвета – каплю загрязненной воды.
Учитель: Ребята, я желаю Вам хорошего настроения и всегда чистой воды! Спасибо!
Интеллектуальная игра «Мир воды»
Планета Вода
1. Как древние греки звали бога морей?
(10б) (Посейдон)
2. По легенде, эта богиня родилась из морской пены.
(20б) (Афродита)
3. У древних народов вода считалась символом плодородия и …
(30б) (Бессмертие)
4. Какая часть поверхности Земли покрыта водой?
(10б) (3/4)
5.В какой жидкости в организме человека содержится 83% воды
(20б) (Кровь)
6.При взаимодействии воды со щелочными металлами образуется
(10б) (Щелочь)
7. При какой температуре вода реагирует с платиной.
(30б) (Не реагирует)
8. Почему в природе не существует химически чистой воды?
(20б) (Вода растворитель)
9. При взаимодействии алюминия с иодом вода используется в качестве…
(30б) (Катализатор)
Тема 7. Количественные отношения в химии и экологии. Решение расчетных задач с экологическим содержанием.
Задача 1. В 1971 г вблизи г.Пейне в Германии в выработанной шахте было захоронено 280т известковой суспензии, содержит 10% мышьяка. В настоящее время 5,6 % мышьяка из суспензии перешло в грунтовые воды,объем которых в районе расположения свалки составляет 3 млн, м3. Оцените степень опасности использования для питья воды из колодцев, если безопасная недельная доза для человека 0,5г мышьяка. При разовом поступлении 1,5-2 мг мышьяка на кг веса человека наступает смерть. Дать токсилогическую характеристику мышьяка.
Задача 2. На берегу реки площадью 5км2 и средней глубиной 2м расположено промышленное предприятие, использующее воду озера для технических нужд и затем сбрасывающее загрязненную воду в озеро.
Рассчитать каким будет загрязнение озера через 1 месяц и 1 год.
Сделать выводы о промышленном загрязнении водоемов и дать рекомендации по сохранению озера.
Дано: объем сбора сточной воды в ед. времени 4 л/сек
Фактическое содержание вредных веществ в сточной воде 25 мг/л
Мышьяк 0,04; ртуть 0,03; свинец 0,42.
Задача 3. В результате аварии на производстве серной кислоты в сточные воды массой 400 кг попало 3,2 кг оксида серы (6). Найдите массовую долю образовавшегося в сточных водах серной кислоты.
Задача 4. Целлюлозно-бумажный комбинат произвел сброс сточных вод. Вычислите объем хлора при н.у., необходимого для очистки 1000 м3 сточных вод от сероводорода. Концентрация сероводорода в сточных водах - 0,05 мг/л.
Задача 5. При производстве фенолформальдегидных пластмасс произошел аварийный сброс фенола в ближайший водоем. Рассчитайте молярную концентрацию фенола в водоеме, если масса воды в нем — 10 000 m, a масса сброшенного фенола составляет 0,5 кг.
Задача 6. В сточных водах химико-фармацевтического комбината был обнаружен хлорид ртути HgCl2, концентрация которого составила 5 мг/л. Для их очистки решили применить метод осаждения и в качестве осадителя использовали сульфид натрия Na2S массой 420 г. Будут ли достаточно очищены сточные воды, чтобы допустить их сброс в соседний водоем, содержащий 10000м3 воды? ПДК(НgС12) = 0,0001 мг/л. Объем сточных вод 300 м3.
Задача 7. Выживут ли караси в озере объемом 500 000 м3, в воду которого попало 100м3 сточных вод сернокислотного завода, содержащих 1600 кг оксида серы(V1)? Токсическая концентрация серной кислоты для карасей равна 138 мг/л.
Задача 8. В сточных водах цеха гальванических покрытий содержится AgNO3 массой 120 кг. Вычислите массу 30 %-ного раствора пероксида водорода Н2О2, необходимого для восстановления ионов серебра до металлического состояния.
Задача 9. В результате аварии в цеху, размеры которого составляют 4 ґ 9 ґ 10 м произошла утечка 23 г 50 %-ного раствора триэтиламина (ПДК = 10 мг/м3). Превышает ли концентрация триэтиламина а помещении его ПДК?
Задача 10. В лаборатории размерами 28 ґ 20 ґ 3 м было разлито 1,62 мл бутиламина (ПДК = 10 мг/м3, r = 0,7401 г/мл) и 1,2 мл дипропиламина (ПДК = 5 мг/м3, r = 0,7384 г/мл). Составляет ли угрозу здоровью персонала такая ситуация?
Тема 6. Загрязнение экосистем тяжелыми металлами. Загрязнение воды.
Ионы металлов являются непременными компонентами природных водоемов. В зависимости от условий среды (pH, окислительно-восстановительный потенциал, наличие лигандов) они существуют в разных степенях окисления и входят в состав разнообразных неорганических и металлорганических соединений, которые могут быть истинно растворенными, коллоидно-дисперсными или входить в состав минеральных и органических взвесей. Истинно растворенные формы металлов, в свою очередь, весьма разнообразны, что связано с процессами гидролиза, гидролитической полимеризации (образованием полиядерных гидроксокомплексов) и комплексообразования с различными лигандами.
Соответственно, как каталитические свойства металлов, так и доступность для водных микроорганизмов зависят от форм существования их в водной экосистеме. Многие металлы образуют довольно прочные комплексы с органикой; эти комплексы являются одной из важнейших форм миграции элементов в природных водах. Большинство органических комплексов образуются по хелатному циклу и являются устойчивыми. Комплексы, образуемые почвенными кислотами с солями железа, алюминия, титана, урана, ванадия, меди, молибдена и других тяжелых металлов, относительно хорошо растворимы в условиях нейтральной, слабокислой и слабощелочной сред. Поэтому металлорганические комплексы способны мигрировать в природных водах на весьма значительные расстояния. Особенно важно это для маломинерализованных и в первую очередь поверхностных вод, в которых образование других комплексов невозможно.
Естественными источниками поступления свинца в поверхностные воды являются процессы растворения эндогенных (галенит) и экзогенных (англезит, церуссит и др.) минералов. Значительное повышение содержания свинца в окружающей среде (в т.ч. и в поверхностных водах) связано со сжиганием углей, применением тетраэтилсвинца в качестве антидетонатора в моторном топливе, с выносом в водные объекты со сточными водами рудообогатительных фабрик, некоторых металлургических заводов, химических производств, шахт и т.д.
Присутствие никеля в природных водах обусловлено составом пород, через которые проходит вода: он обнаруживается в местах месторождений сульфидных медно-никелевых руд и железо-никелевых руд. В воду попадает из почв и из растительных и животных организмов при их распаде. Повышенное по сравнению с другими типами водорослей содержание никеля обнаружено в сине-зеленых водорослях. Соединения никеля в водные объекты поступают также со сточными водами цехов никелирования, заводов синтетического каучука, никелевых обогатительных фабрик. Огромные выбросы никеля сопровождают сжигание ископаемого топлива. Концентрация его может понижаться в результате выпадения в осадок таких соединений, как цианиды, сульфиды, карбонаты или гидроксиды (при повышении значений рН), за счет потребления его водными организмами и процессов адсорбции. В поверхностных водах соединения никеля находятся в растворенном, взвешенном и коллоидном состоянии, количественное соотношение между которыми зависит от состава воды, температуры и значений рН. Сорбентами соединений никеля могут быть гидроксид железа, органические вещества, высокодисперсный карбонат кальция, глины.
В природные воды соединения кобальта попадают в результате процессов выщелачивания их из медноколчедановых и других руд, из почв при разложении организмов и растений, а также со сточными водами металлургических, металлообрабатывающих и химических заводов. Некоторые количества кобальта поступают из почв в результате разложения растительных и животных организмов. Соединения кобальта в природных водах находятся в растворенном и взвешенном состоянии, количественное соотношение между которыми определяется химическим составом воды, температурой и значениями рН.
В настоящее время существуют две основные группы аналитических методов для определения тяжелых металлов: электрохимические и спектрометрические методы. В последнее время с развитием микроэлектроники электрохимические методы получают новое развитие, тогда как ранее они постепенно вытеснялись спектрометрическими методами. Среди спектрометрических методов определения тяжелых металлов первое место занимает атомно-абсорбционная спектрометрия с разной атомизацией образцов: атомно-абсорбционная спектрометрия с пламенной атомизацией (FAAS) и атомно-абсорбционная спектрометрия с электротермической атомизацией в графитовой кювете (GF AAS). Основными способами определения нескольких элементов одновременно являются атомная эмиссионная спектрометрия с индукционно связанной плазмой (ICP-AES) и масс-спектрометрия с индукционно связанной плазмой (ICP-MS). За исключением ICP-MS остальные спектрометрические методы имеют слишком высокий предел обнаружения для определения тяжелых металлов в воде.
Определение содержание тяжёлых металлов в пробе производится путем перевода пробы в раствор – за счет химического растворения в подходящем растворителе (воде, водных растворах кислот, реже щелочей) или сплавления с подходящим флюсом из числа щелочей, оксидов, солей с последующим выщелачиванием водой. После этого соединение искомого металла переводится в осадок добавлением раствора соответствующего реагента – соли или щелочи, осадок отделяется, высушивается или прокаливается до постоянного веса, и содержание тяжёлых металлов определяется взвешиванием на аналитических весах и пересчетом на исходное содержание в пробе. При квалифицированном применении метод дает наиболее точные значения содержания тяжёлых металлов, но требует больших затрат времени.
Для определения содержания тяжёлых металлов электрохимическими методами пробу также необходимо перевести в водный раствор. После этого содержание тяжёлых металлов определяется различными электрохимическими методами – полярографическим (вольтамперометрическим), потенциометрическим, кулонометрическим, кондуктометрическим и другими, а также сочетанием некоторых из перечисленных методов с титрованием. В основу определения содержания тяжёлых металлов указанными методами положен анализ вольт-амперных характеристик, потенциалов ион-селективных электродов, интегрального заряда, необходимого для осаждения искомого металла на электроде электрохимической ячейки (катоде), электропроводности раствора и др., а также электрохимический контроль реакций нейтрализации и др. в растворах. С помощью этих методов можно определять тяжёлые металлы до 10-9 моль/л.
Практическая работа «Определение содержания железа в природной воде»
В природной воде железо содержится в виде ионов Fe2+ и Fe3+. Одним из простейших способов определения железа является калориметрический. Он основан на образовании интенсивно окрашенного роданида железа(III), причем интенсивность окраски пропорциональна содержанию железа(III).
В Вашем распоряжении природная вода, персульфат натрия (персульфат-ион - сильный окислитель, восстанавливается до сульфат-иона), раствор роданида аммония, стандартный раствор содержащий 0.100 мг/мл иона Fe(III), лабораторная посуда и оборудование.
Определите общее содержание железа в выданной воде по следующей методике:
В одну из двух одинаковых колб налейте 50 мл исследуемой воды, в другую - 50 мл дистиллированной воды. В каждую добавьте примерно по 1 мл растворов персульфата аммония и роданида аммония. Спустя пять минут сравните окраски растворов.
Если окраски отличаются, при постоянном перемешивании добавляйте в колбу с дистиллированной водой стандартный раствор соли железа(III) до тех пор, пока окраски растворов не станут одинаковыми. Предварительно подготовьте бюретку, установите начальный объем раствора на 0. Запишите затраченный объем раствора. Для повышения надежности определения повторите определение еще 2-3 раза и найдите среднее значение объема раствора.
Оформление отчета: напишите уравнения реакций в молекулярном и ионном виде. Для расстановки коэффициентов в уравнениях окислительно-восстановительных реакций используйте метод электронного баланса или полуреакций.
Выведите формулу для расчета содержания железа, используя обозначения: c - концентрация железа, мг/л, V(ст) - средний объем стандартного раствора, мл, V(в) - объем пробы воды, мл
с= V(ст)*с(ст)*1000/V(в)
Укажите результаты каждого опыта, найденное среднее значение. Рассчитайте общее содержание железа в воде.
Оцените пригодность этой воды к употреблению, учитывая, что ПДК железа - 0.5 мг/л.
Приложения (перечень одолженных книг, лабораторного оборудования из фонда кафедры)
Лабораторное оборудование:
1. пробирки
2. мерная пробирка
3. стеклянная палочка
4. спиртовка
5. фильтровальная бумага
6. воронка
7. стакан
8. пробиркодержатель
9. универсальная индикаторная бумага
10. колба
11. кристализатор
12. лучинка
13. разновесы
14. весы
15. мерная колба
16. лакмусовая бумага
Химические реактивы:
1. известковая вода
2. дистиллированная вода
3. 10% р-р хлорида калия
4. Мел (мрамор)
5. Гидрокарбонат натрия 5%
6. Соляная кислота (1:1)
7. Цинк
8. Натрий
9. Кальций
10. Оксид кальция
11. Персульфат натрия
12. Роданид аммония
13. Соль железа (3)
Анкетирование по теме: «Выявление мотивации к изучению предмета химии и в частности окружающей среды»
1. Фамилия Имя Отчество ___________________________________
2. В каком классе вы учитесь: 8 9 10 11
3. Имеет ли ваша школа или класс специализацию? (какую?)
_________________________________________________________
Название школы ____________________________________________
__________________________________________________
4. Ты выбрал предмет химия в качестве профильного обучения потому что: (выбери 5 ответов по убыванию их значимости).
a) Мне очень интересен, нравится этот предмет.
b) У нас самый замечательный, профессиональный учитель химии.
c) Родители посоветовали (заставили).
d) Его выбрали мои друзья, а я как они.
e) Химию мне придется сдавать при поступлении в ВУЗ.
f) Хочу, чтобы моя будущая профессия была связана с химией.
g) Мечтаю стать учителем химии.
h) У меня есть хорошие способности к изучению химии.
i) Свой вариант ответа____________________________
5. Что тебе нравится на уроке химии больше всего? (выбери 3 по убыванию их значимости)
a) Объяснение материала учителем.
b) Самостоятельная работа.
c) Хорошая эмоциональная обстановка в классе
d) Другие формы (указать какие).
6. Проводятся ли для Вас на уроке химии лабораторные работы?
a) Да
b) Нет
c) Редко
7. Показывает ли Вам учитель демонстрационный опыт?
a) Да, всегда.
b) Нет, очень редко.
c) Иногда.
8. Участвуете ли вы в научных конференциях по химии?
a) Да
b) Нет
9. Участвуете ли вы в химических олимпиадах школы по химии?
a) Да
b) Нет
10. Знаете ли Вы, что такое окружающая среда и мониторинг окружающей среды?_______________________________________________________
11. Необходимо ли в городе поддерживать чистоту?______________
12. Согласны ли Вы с тем, что автомобильные выхлопы приносят вред окружающей среде?_________________________________________________
13.Стоит ли организовывать свалку в черте города?_________________
14. Согласны ли Вы с тем, что реки и озёра в нашей стране загрязнены?_____________________________________________
15. Стоит ли организовывать больше заповедников?____________________________
16. Вредит ли осушение озёр окружающей среде?_____________________
17. Необходимо ли приучать детей к охране окружающей среды?_________________________________________________________
18. Поддерживаете ли Вы взгляды организации «Green Peace» (Грин Пис)?__________
19. Согласны ли Вы с тем, что загрязнение окружающей среды ведёт к серьёзным заболеваниям?________________________________________
20.Верите ли Вы в глобальное потепление?__________________________
Тестирование
1. Под загрязнением окружающей среды понимают:
a. привнесение в среду новых, нехарактерных для нее физических, химических и биологических компонентов
b. привнесение в среду новых, нехарактерных для нее физических, химических и биологических компонентов, а также превышение естественного уровня этих компонентов
c. превышение естественного уровня природных и антропогенных компонентов среды
d. рост антропогенного влияния на природные экосистемы
2. Загрязнение атмосферы в России в первую очередь вызывается:
a. химической промышленностью
b. теплоэнергетикой
c. сельским хозяйством
d. нефтедобычей и нефтехимией
3. Наиболее опасное загрязнение почв вызывается:
a. бытовыми отходами
b. отходами сельского хозяйства
c. тяжелыми металлами
d. сточными водами
4. Наибольшее загрязнение вод суши вызывают:
a. смыв удобрений и пестицидов с полей
b. бытовые и промышленные сточные воды
c. загрязнение твердыми бытовыми отходами
d. дампинг
5. Наибольшее загрязнение вод Мирового океана вызвано:
a. дампингом
b. кислотными дождями
c. отходами сельского хозяйства
d. нефтью и нефтепродуктами
6. Загрязнения, обнаруживаемые вокруг промышленных предприятий, называются:
a. локальные
b. региональные
c. глобальные
d. санитарно-защитные
7. Если загрязняющее вещество, поступающее в окружающую среду, не вызывает отрицательных последствий, но в ходе физико-химических процессов становится опасным, то такое загрязнение называют:
a. первичным
b. вторичным
c. устойчивым
d. неустойчивым
8. Примером физико-химического загрязнения окружающей среды является:
a. арктический смог
b. изменение параметров БПК/ХПК
c. радиоактивное загрязнениер
d. промышленный смог
9. К химическому загрязнению не относятся:
a. загрязнение тяжелыми металлами
b. попадание пестицидов в водоемы
c. загрязнение почв твердыми бытовыми отходами
d. увеличение концентрации фреонов в атмосфере
10 Загрязнение окружающей среды твердыми бытовыми отходами можно отнести к:
a. физическому загрязнению
b. биологическому загрязнению
c. механическому загрязнению
d. физико-химическому загрязнению
11 К санитарно-гигиеническим нормативам относят:
a. предельно допустимый выброс (ПДВ) и предельно допустимый сброс (ПДС)
b. предельно допустимые нагрузки (ПДН)
c. предельно допустимые нагрузки (ПДН) и предельно допустимые концентрации (ПДК)
d. предельно допустимые концентрации (ПДК)
12. К производственно-хозяйственным нормативам качества окружающей среды относят:
a. предельно допустимый выброс (ПДВ) и предельно допустимый сброс (ПДС)
b. предельно допустимые нагрузки (ПДН)
c. предельно допустимые нагрузки (ПДН) и предельно допустимые концентрации (ПДК)
d. предельно допустимые концентрации (ПДК)
13. Предельно допустимые нагрузки относят к:
a. комплексным нормативам
b. производственно-хозяйственным нормативам
c. региональным нормативам
d. санитарно-гигиеническим
14. При определении ПДК учитывают:
a. влияние вещества на здоровье человека и круговороты веществ
b. влияние вещества на природные сообщества
c. влияние на круговороты веществ
d. влияние вещества на здоровье человека
15. Принятый норматив имеет юридическую силу с момента:
a. окончания его разработки
b. утверждения соответствующим компетентным органом
c. поступления положительных отзывов из санитарных служб
d. соответствующей корректировки в ту или иную стороны
16. Временно согласованные выбросы устанавливают для:
a. поэтапного снижения выбросов
b. наложения штрафных санкций на работающие предприятия
c. нахождения величин ПДК
d. установления комплексных нормативов качества
17. Главным критерием при разработке предельно допустимых экологических нагрузок является:
a. время жизни загрязняющих веществ в окружающей среде
b. влияние на организм человека
c. устойчивость экосистем в целом
d. влияние на наименее устойчивый к данному загрязнению вид в экосистеме
18. Концентрация загрязняющего вещества, которая не должна оказывать на человека прямого или косвенного воздействия при неограниченном вдыхании называется:
a. максимальная разовая
b. рабочей зоны
c. интегральным показателем чистоты воздуха
d. среднесуточной
19. Интегральные показатели качества воды позволяют судить:
a. об эффективности процессов самоочищения водоема
b. о степени загрязнения водоема неорганическими веществами
c. о содержании в водоеме живых организмов
d. об общем количестве загрязняющих веществ, попадающих в водоем за определенный промежуток времени
20. На сложность определения ПДК для почв влияет:
a. активная микробиологическая жизнь в почве
b. многообразие типов почв
c. малая подвижность веществ в почве
d. все перечисленные факторы
Олимпиада по химии – 2015, школьный этап
10 класс
Задание 1. Дайте названия нижеперечисленным органическим соединениям по систематической номенклатуре (IUPAC). Для каких соединений характерна геометрическая изомерия. Приведите 2 примера и дайте им названия.
| Формулы | Название |
| СH2 = CHCl | |
| CН3CH(СН3) – CH(C2H5) - CH(C2H5) –CH(C3H7) –(CH2)2 –CH3 | |
| СН3 - СН = СН – СН3 | |
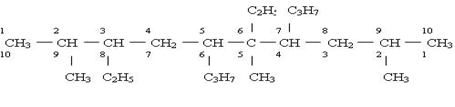
| |
| CICH2-CH2COOH | |
| ClCH2 - CH2 - CH2 - CH2 -CH -CH2 –CH(OH) -CH3 CH2OH | |
| Итого: | 10 баллов |
Задание 2.
К раствору, содержащему 11,9 г нитрата серебра, прибавили раствор, содержащий 2,67 г хлорида алюминия. Осадок отфильтровали и фильтрат выпарили. Определите количество образовавшегося осадка, массу и состав остатка после выпаривания фильтрата, если образуется девятиводный кристаллогидрат.
Задание 3. Восстановите левую часть уравнений реакций.
1) …. + ….→ t 2Fe2O3 + 2FeCl3
2) ….. + ….. → t 3Cu↓ + CuCl2 + N2↑ + 2CO2↑ + 6H2O
3) …. + …. → CaCl2 + 2S↓ + 2HCl
4) …. + … + H2O → 6S↓ + 4MnO2↓ + 2KHCO3 + K2CO3
5) …. + … → 2NH3↑ + CaCO3↓
6) …. + …. → CO2↑ + 2HCl
7) … + … → 2Na2CO3 + O2↑
8) … + … 3Fe↓ + N2↑+ 3H2O
9) … + … + 2HCl → NO↑ + FeCl3 + NaCl + H2O
10) …. 4NO2↑ + O2↑ + 2H2O
12 баллов
Задание 4. Оксид А некоторого металла, проявляющего переменную валентность в соединениях, при нагревании до температуры 420 °С образует два оксида В и С. При 600 °С В разлагается с выделением кислорода, образуя оксид С. Массовые доли металла в оксидах А,В и С составляют соответственно 86,62%, 90,67% и 92,83%.
Определите металл М в оксидах, установите формулы оксидов А, В и С, приведите уравнения реакций термического разложения оксидов А и В.
* Составьте уравнения реакций взаимодействия:
a) оксида А с концентрированным горячим раствором соляной кислоты;
б) оксида А с концентрированным горячим раствором едкого натра;
в) оксида А сернистым газом;
г) оксида В с разбавленной азотной кислотой;
д) оксида В с концентрированным горячим раствором едкого натра.
Задание 5. Хлорофилл является важным пигментом, обусловливающим Зеленый цвет листьев растений. При сжигании 89,2 мг хлорофилла в избытке кислорода получаются только следующие четыре вещества: 242 мг газа, которым обычно газируют напитки; 64,8 мг жидкости, составляющей основу этих напитков; 5,6 мг газа, которого больше всего в земной атмосфере и 4,00 мг белого порошка, который является оксидом легкого широко Используемого металла, составляющего приблизительно 2,3 % земной коры.
1) О каких веществах идет речь?
2) Рассчитайте формулу хлорофилла, учитывая, что его молекула содержит только один атом металла.
3) Напишите уравнение реакции горения хлорофилла.
4) Содержит ли хлорофилл хлор? Откуда взялось название «хлорофилл»?
5) Приведите пример природного вещества, содержащего фрагмент структуры сходного строения.
Не нашли, что искали? Воспользуйтесь поиском: