
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Первое начало термодинамики.
Лекция 27. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
ВУНТРЕННЯЯ ЭНЕРГИЯ СИСТЕМЫ. РАБОТА И ТЕПЛОТА.
ТЕПЛОЕМКОСТЬ. ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА.
УРАВНЕНИЕ АДИАБАТЫ ДЛЯ ИДЕАЛЬНОГО ГАЗА
Первое начало термодинамики.
Внутренняя энергия системы. Работа и теплота
Первое начало термодинамики является частным случаем общего закона сохранения энергии. Содержание первого начала может быть сформулировано следующим образом: при переходе системы из начального состояния 1 в конечное состояние 2, получаемая системой от окружающей среды сумма теплоты Q, энергии переноса массы Z (Z — энергия, которая передается системе при переносе массы вещества из окружающей среды в систему) и совершаемой средой работы А', определяется только состояниями 1 и 2; эта сумма не зависит от того, каким способом осуществляется переход из 1 в 2.
Это означает, что существует такая величина U, характеризующая внутреннее состояние системы, разность значений которой в состояниях 1 и 2 определяется соотношением
U2 — U2 = Q + Z + A '. (27.1)
Величина U представляет собой внутреннюю энергию системы. Внутренняя энергия — это энергия, заключенная в системе. При этом обычно не учитывается кинетическая энергия системы в целом и потенциальная энергия системы во внешнем поле (хотя в некоторых случаях потенциальную энергию можно рассматривать как часть внутренней энергии). При микроскопическом рассмотрении внутренняя энергия равна сумме кинетической энергии теплового движения молекул, энергии взаимодействия между ними, а также внутриатомной и ядерной энергии. Однако термодинамика не затрагивает вопрос о природе внутренней энергии. Из первого начала термодинамики вытекает, что внутренняя энергия U является функцией состояния системы и, следовательно, не зависит от способа перехода системы из одного состояния в другое.
Величина внутренней энергии определяется с точностью до некоторой аддитивной постоянной. Эту постоянную можно зафиксировать, выбрав внутреннюю энергию исходного состояния системы за нулевую точку отсчета внутренней энергии.
Соотношение (27.1) представляет выражение наиболее общей формулировки первого начала термодинамики.
Существуют частные формулировки. Рассмотрим некоторые из них. Если система закрытая, то Z = 0, так как система не обменивается веществом с окружающей средой. В этом случае соотношение (27.1) представится как
U2 — U1 = Q+A'. (27.2)
Работа А', совершаемая средой над системой, может быть заменена взятой с обратным знаком работой А, которую система совершает над средой (А' =—А). С учетом этого обстоятельства из (27.2) вытекает, что
Q = A + U 2 — U1, (27.3)
Следовательно, согласно (27.3), первое начало термодинамики для закрытой системы можно сформулировать следующим образом: теплота, подводимая к закрытой системе, идет на изменение внутренней энергии и на работу, совершаемую системой над окружающей средой. При сообщении системе малого (элементарного) количества теплоты δ Q первое начало термодинамики (27.3) записывается в дифференциальной форме:
δ Q = δ A + dU. (27.4)
В (27.4) различные обозначения изменений δ Q, δ А и dU подчеркивают то обстоятельство, что U, в отличие от Q и А, является функцией состояния системы, для которой при любом циклическом процессе полное изменение внутренней энергии тождественно равно нулю ( ) и, следовательно, dU представляет полный дифференциал. Работа А и теплота Q не являются функциями состояния системы, они
) и, следовательно, dU представляет полный дифференциал. Работа А и теплота Q не являются функциями состояния системы, они  зависят от условий перехода термодинамической системы изодного состояния в другое. Их изменения зависят от пути перехода, и они называются вариациями. Покажем это на примере закрытой системы, представляющей собой газ, находящийся в цилиндре с подвижным поршнем площадью S (рис. 28.1). В общем случае работа, произведенная системой, состоит в смещении границы ее поверхности S, следовательно, в изменении ее объема V и преодолении при этом некоторого давления рвн внешней среды (рис. 28.1). В случае квазистатического процесса в любой момент времени давление газа р будет равно внешнему давлению р вн (р = р вн). С учетом этого обстоятельства работа, совершаемая силой F = pS при смещении границы поверхности на малый отрезок dx, будет равна
зависят от условий перехода термодинамической системы изодного состояния в другое. Их изменения зависят от пути перехода, и они называются вариациями. Покажем это на примере закрытой системы, представляющей собой газ, находящийся в цилиндре с подвижным поршнем площадью S (рис. 28.1). В общем случае работа, произведенная системой, состоит в смещении границы ее поверхности S, следовательно, в изменении ее объема V и преодолении при этом некоторого давления рвн внешней среды (рис. 28.1). В случае квазистатического процесса в любой момент времени давление газа р будет равно внешнему давлению р вн (р = р вн). С учетом этого обстоятельства работа, совершаемая силой F = pS при смещении границы поверхности на малый отрезок dx, будет равна
δ А = Fdx = р∙Sdx = pdV, (27.5)
где dV = S∙dx — элементарное изменение объема газа.
При расширении газа dV > 0 и δ А > 0; в случае сжатия dV < 0 и δ А < 0, так как давление газа всегда положительно. Формула (27.5) дает выражение для элементарной работы. Для того чтобы найти работу А, совершаемую системой (газом) при переходе из состояния 1 в состояние 2, необходимо проинтегрировать (27.5):
 . (27.6)
. (27.6)
Пусть газ расширяется от объема V 1до V 2при неизменном давлении р = const (рис. 28.2, а). Тогда из (27.6) следует, что работа, совершаемая газом, будет равна
 . (27.7)
. (27.7)
Vi Vi

На рис. 28.2, а эта работа соответствует заштрихованной площади фигуры, ограниченной графиком изобарного процесса и ординатами начального и конечного состояния газа (V1 и V2).
Расширение газа от объема V1 до V2 может происходить также при неизменной температуре Т = const (рис. 28.2, б), т. е. изотермически. В этом случае работа, совершаемая газом, будет иной:
 . (27.8)
. (27.8)
При выводе формулы (27.8) было использовано уравнение состояния идеального газа, из которого давление газа 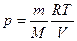 .
.
В диаграмме р, V, как и в случае изобарного процесса, работа А представляется заштрихованной площадью фигуры, ограниченной графиком изотермического процесса (pV = const) и ординатами начального и конечного состояния газа V1 до V2.
Если расширение газа протекает адиабатически, т. е. без теплообмена с окружающей средней (δ Q = 0), то, как следует из первого начала термодинамики (27.4), δ А = — dU и
 , (27.9)
, (27.9)
где U1 и U2 — внутренняя энергия термодинамической системы в начальном и конечном состоянии соответственно.
Учитывая, что для идеального газа  и
и  , формула (27.9) запишется
, формула (27.9) запишется
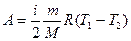 . (27.10)
. (27.10)
Из выражений (27.7), (27.8) и (27.10) видно, что работа при расширении идеального газа зависит от характера процесса. Она различна для изобарного, изотермического и адиабатического процессов. Для изохорного процесса (V = const, dV = 0) работа равна нулю. При циклическом процессе работа, совершаемая за цикл, может быть рассчитана аналитически по формуле
 (27.11)
(27.11)
или графически, как площадь заштрихованной фигуры, ограниченной циклом, в диаграмме состояний термодинамической системы (рис. 28.3).
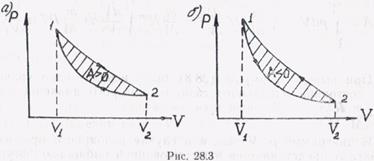
Причем в случае прямого направления протекания цикла (ветвь расширения 1—2 лежит выше ветви сжатия 2—1) работа положительна (рис. 28.3, а), при обратном направлении цикла (ветвь расширения 1—2 лежит ниже ветви сжатия 2—1) работа отрицательна (рис. 28.3, б).
2. Теплоемкость. Теплоемкость идеального газа
Подводимое к системе элементарное количество теплоты δ Q в общем случае можно записать в форме
δQ = CdT, (27.12)
где dT — элементарное увеличение температуры; С — теплоемкость системы (тела).
Как видно из (27.12), теплоемкость системы (тела) численно равняется количеству тепла, которое требуется сообщить системе (телу), чтобы увеличить его температуру на один градус
 . (27.13)
. (27.13)
Теплоемкость единицы массы системы (тела) называется удельной теплоемкостью одного моля вещества — молярной теплоемкостью.
Теплоемкость термодинамической системы зависит от ее массы, химического состава и от вида процесса, в ходе которого к системе подводится теплота.
Получим молярные теплоемкости идеального газа для изохорного Cυ, изобарического Ср, адиабатического Са и изотермического С тпроцессов. Для этого воспользуемся выражением (27.13) и первым началом термодинамики (27.4).
Для изохорного процесса, как следует из первого начала термодинамики, δ Q = dU и, следовательно, теплоемкость
 . (27.14)
. (27.14)
Подставляя в (27.14) для 1 моля идеального газа
 ,
,
получим
 . (27.15)
. (27.15)
При изобарном процессе
δQ = dU + pdV
и теплоемкость будет
 . (27.16)
. (27.16)
Подставив в (27.16)
 , и
, и 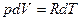
имеем
 . (27.17)
. (27.17)
Адиабатический процесс протекает без теплообмена термодинамической системы с окружающей средой (δ Q = 0). Следовательно, теплоемкость системы в таком процессе отсутствует:
 . (27.18)
. (27.18)
В случае изотермического процесса, когда Т = const и dT = 0, теплоемкость системы бесконечная величина:
 , (27.19)
, (27.19)
Таким образом, молярная теплоемкость идеального газа (27.15), (27.17), (27.18), (27.19) в различных процессах различна, поэтому и теплота, подводимая к идеальному газу для его нагревания из состояния с температурой Т1 до состояния Т2, также будет разная.
Действительно, если в указанном интервале температуры от Т1 до Т2 теплоемкость не изменяется, то из (27.12) получаем
 . (27.20)
. (27.20)
Подставляя в (27.20) вместо С значения из (27.15), (27.17), имеем:
изохорный процесс
 . (27.21)
. (27.21)
изобарный процесс
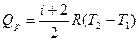 . (27.22)
. (27.22)
3. Уравнение адиабаты для идеального газа
Как уже отмечалось, термодинамический процесс, при котором система не получает и не отдает тепло (δ Q = 0), называется адиабатическим.
Из первого начала термодинамики следует, что для этого процесса
δ А = —dU, (27.23)
т. е. работа совершается за счет изменения внутренней энергии системы.
Адиабатический процесс осуществляется в теплоизолированной системе. Требования к теплоизоляции определяются временем протекания процесса. Если процесс протекает достаточно быстро, теплообмен не успевает произойти, и процесс будет адиабатическим; если же процесс протекает медленно, требования к теплоизоляции становятся более жесткими. В дальнейшем предположим, что адиабатический процесс должен протекать настолько медленно, чтобы состояние системы можно было считать равновесным в любой момент времени. Рассмотрим в качестве закрытой адиабатической системы один моль идеального газа.
Бесконечно малая работа при квазистатическом процессе изменения объема на величину dV равна δ А = pdV, а бесконечно малое изменение внутренней энергии одного моля газа  .
.
Поэтому при адиабатическом процессе на основании (27.23) имеем
pdV = — CυdT. (27.24)
Полученное соотношение показывает, что при адиабатическом расширении температура газа падает, а при адиабатическом сжатии температура газа растет. Это объясняется тем, что при расширении газ совершает работу за счет уменьшения своей внутренней энергии, а при сжатии работа внешних сил идет на увеличение внутренней энергии газа.
Воспользовавшись уравнением состояния идеального газа, перепишем уравнение (27.24) в виде
 . (27.25)
. (27.25)
Используя связь между Ср и Cυ (27.17), имеем
R = Ср — Cυ. (27.26)
Подставив (27.26) в (27.25) и обозначив  , получим
, получим
 или
или  .
.
Считая γпостоянной величиной, запишем последнее соотношение в виде
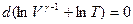 ,
,
откуда
 . (27.27)
. (27.27)
или окончательно
 .
.
Величина γназывается показателем адиабаты и для газов  , где i — число степеней свободы молекул. Для одноатомных газов
, где i — число степеней свободы молекул. Для одноатомных газов 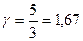 , для двухатомных
, для двухатомных 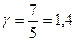 , для многоатомных
, для многоатомных  .
.
Формула (27.27) означает, что между температурой Т 1и объемом V 1газа в начальном состоянии и температурой Т 2 и объемом V 2 газа в конечном состоянии, возникшем в результате адиабатического процесса, существует соотношение
 или
или  .
.
Преобразуем полученное соотношение, воспользовавшись уравнением состояния идеального газа. Из уравнения состояния следует, что
 или
или  ,
,
поэтому для адиабатического процесса получаем
 или
или  .
.
Таким образом, при адиабатическом процессе с идеальным газом
pV γ = const. (27.28)
Выражения (27.27) и (27.28) называют уравнением адиабаты. График адиабатического процесса (адиабаты) изображен на рис. 28.4. Для сравнения на этом же рисунке дан график изотермического процесса, для которого pV = const. При адиабатическом расширении давление убывает быстрее, чем при изотермическом, так как γ > 1.

| <== предыдущая лекция | | | следующая лекция ==> |
| Плазма. Концентрация зарядов. Процессы ионизации, | | | ЕГО КПД. НЕРАВЕНСТВО КЛАУЗИУСА |
Не нашли, что искали? Воспользуйтесь поиском: