
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Определение фосфорной кислоты в казеине. Обнаружение фосфорной кислоты в белках, в том числе в составе казеина можно осуществить с использованием молибдата аммония или магнезиальной смеси.
Обнаружение фосфорной кислоты в белках, в том числе в составе казеина можно осуществить с использованием молибдата аммония или магнезиальной смеси.
Фосфорная кислота образует с молибденовым реактивом желтый кристаллический осадок фосфорномолибденовокислого аммония:
H3PO4 + 12 (NH4)2MoO4 + 21 HNO3 → (NH4)3PO4 · 12MoO3 +
+ 21 NH4NO3 + 12 H2O.
Реакция с магнезиальной смесью основана на образовании кристаллического осадка фосфата магний-амония MgNH4PO4 в ходе двух последовательных реакций: образования фосфата аммония и взаимодействия данной соли со смесью хлорида магния и хлорида аммония.
Гемопротеиды
Гемсодержащие белки участвуют в процессах транспорта электронов, транспорта кислорода, фотосинтеза. Классическими представителями сложных белков этой группы являются миоглобин и гемоглобин. На примере этих гемопротеидов можно четко проследить связь между структурой и функцией глобулярных белков. Данные гемопротеиды содержат в качестве простетической группы гем – циклический тетрапиррол, включающий атом железа, присутствие которого объясняет красный цвет данных белков и их способность запасать кислород (миоглобин) или обеспечивать его транспорт (гемоглобин). Тетрапирролы состоят из четырех молекул пиррола (рис. 3.1), связанных между собой четырьмя a-метиновыми мостиками, что обеспечивает образование плоской (планарной) кольцевой структуры, несущей в определенных положениях соответствующие заместители.

Рис. 3.1 Структурная формула пиррола.
В тетрапиррольных структурах могут присутствовать разные b-заместители представленные метильными (М), винильными (V) и пропионатными (Pr) группами. Например, в составе гема указанные заместители расположены в следующем порядке: M, V, M, V, M, Pr, Pr, M (рис. 3.2).

Рис. 3.2. Структура гема.
В центре плоского тетрапиррольного кольца находится один атом железа в ферро-(Fe2+)-состоянии. Похожие по строению простетические группы, содержащие ионы металлов, обнаруживают и в других белках: цитохромах, хлорофилл-содержащих белках (Mg2+) и некоторых ферментах, например, каталазе, триптофанпирролазе и других. В цитохромах происходит циклическое окисление и восстановление атома железа (Fe2+ ↔ Fe3+), играющее определяющую роль в их функционировании. Напротив, окисление Fe2+ до Fe3+ в миоглобине или гемоглобине сопровождается потерей их биологической активности.
Миоглобин
Миоглобин, содержащийся в клетках скелетных мышц, запасает кислород в связанном состоянии и способствует его передаче в митохондрии, которые в процессе окисления поступающих в клетку питательных веществ кислород потребляют и генерируют АТР необходимый для мышечного сокращения. Миоглобин в пять раз быстрее, чем гемоглобин связывает кислород (другими словами имеет более высокое сродство к кислороду, чем гемоглобин).
Миоглобин состоит из единичной полипептидной цепи, состоящей из 153 аминокислотных остатков и одной гемо-группы (рис. 3.3). В результате проведенного рентгеноструктурного анализа было сделано несколько важных выводов относительно организации молекулы этого гемопротеида:
1. 75% полипептидной цепи находится в конформации a-спирали (все a-спирализованные участки являются правозакрученными). Обнаружено 8 основных участков спирализации, которые обозначены первыми буквами латинского алфавита: А, B, C, D, E, F, G и H. Спирализованные участки разделены 5 неспирализованными участками; такие же неспирализован-ные области находятся на концах цепи.
2. Молекула миоглобина настолько компактна, что внутри нее может уместиться всего четыре молекулы воды.
3. Все полярные радикалы, за исключением двух (два остатка гистидина принимают участие в связывании кислорода), расположены на внешней поверхности молекулы.
4. Большая часть гидрофобных радикалов расположена внутри молекулы миоглобина и таким образом защищены от соприкосновения с водой.
5. Каждый из четырех остатков пролина в молекуле миоглобина находится в месте изгиба полипептидной цепи. В других местах изгиба или поворотацепи расположены остатки серина, треонина и аспарагина.
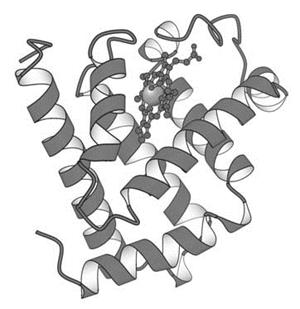
Рис. 3.3. Пространственная модель молекулы миоглобина
Гемоглобин
Гемоглобины – это структурно-родственные белки эритроцитов позвоночных, выполняющие две важные биологические функции: 1) перенос О2 из легких к периферическим тканям; 2) перенос СО2 и протонов от периферических тканей к дыхательным органам для последующего выделения из организма. Гемоглобины представляют собой тетрамерные белки, молекулы которых образованы попарно ассоциированными разными типами полипептидных цепей, которые обозначаются буквами a, b, g, d, S и др. В состав тетрамерной молекулы входят по две цепи двух разных типов. Гемоглобин взрослого человека, обозначаемый А1, состоит из двух a- и двух b-цепей. Их длина примерно одинакова – a-цепь содержит 141 остаток, а b-цепь – 146. В молекуле гемоглобина гем расположен в щели между двумя a-спирализованными участками каждой цепи (рис. 3.4).

Рис. 3.4. Структура гемоглобина человека.
Пропионатные группы гема ориентированы к поверхности глобулы, а другие заместители обращены внутрь глобулы и окружены неполярными (гидрофобными) аминокислотными остатками. Исключение составляют два остатка гистидина – проксимальный и дистальный, которые расположены вблизи атома железа. Причем, атом азота гетероциклического кольца проксимального гистидина связан пятой координационной связью с атомом железа (четыре другие связи атом железа образует с азотами пиррольных колец гема). В норме дистальный гистидин не взаимодействует с атомом железа, который предназначен для связывания молекулы кислорода.
Свойства индивидуальных гемоглобинов определяются их олигомерной организацией. Наиболее изученными гемоглобинами являются:
гемоглобин взрослого человека – HbA1, имеющий структуру a2b2. В эритроцитах здорового взрослого человека гемоглобин А1 является основным вариантом гемоглобина и составляет в норме почти 97% общего гемоглобина эритроцитов. На долю минорного гемоглобин взрослого человека HbA2, представленного тетрамером a2d2, приходится около 3%.
Фетальный гемоглобин HbF, состоящий из цепей a2g2 присутствует и в крови взрослого человека, но в норме его содержание не превышает 1% от общего количества гемоглобина крови взрослого и определяется в 1-7% от общего числа эритроцитов крови. Однако у плода эта форма гемоглобина является доминирующей.
Серповидноклеточный гемоглобин HbS относится к мутантным гемоглобинам. Этот особый мутантный вариант гемоглобина, образующийся у больных с серповидно-клеточной анемией, в отличие от нормальной формы гемопротеида растворенной в цитоплазме эритроцита склонен к кристаллизации в красных кровяных клетках in vivo. В гемоглобине S по сравнению с нормальным гемоглобином Α в β-цепях имеется единичная аминокислотная замена: в 6-й позиции нормальной β-цепи глобина L-глутаминовая кислота замещена на L-валин. Поскольку валин имеет неполярный радикал, располагающийся на поверхности молекулы, в результате этой замены растворимость гемоглобина резко падает. Общая формула тетрамеров гемоглобина S записывается как a2S2.
Четвертичная (олигомерная) структура наделяет гемоглобин важными особенностями, которые способствуют выполнению его уникальной биологической функции и обеспечивают возможность строгой регуляции его свойств.
Выделяют пять форм гемоглобина: 1) оксигемоглобин; 2) дезокси-гемоглобин 3) карбоксигемоглобин; 4) карбгемоглобин; 5) метгемоглобин.
Оксигемоглобин (oxyhemoglobin) – форма гемоглобина, образующаяся в результате его оксигенации, то есть присоединения к каждому гему молекулы кислорода. Такая способность обусловлена присутствием двухвалентного иона железа в геме. Образование оксигемоглобина сопровождается конформационной перестройкой молекулы гемоглобина.
Карбоксигемоглобин (carboxyhemoglobin) – трудно диссоциирующее соединение гемоглобина и угарного газа. Переизбыток в крови карбоксигемоглобина приводит к кислородному голоданию, так как угарный газ, прочно связанный с гемоглобином, лишает его возможности присоединять к себе кислород.
Карбгемоглобин (carbhemoglobin) – соединение гемоглобина с углекислым газом (СО2), участвует в обмене СО2 в организме животных и человека. Гемоглобин не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт СО2 от тканей к легким. Данный гемопротеид связывает СО2 сразу же после высвобождения кислорода, при этом примерно 15% СО2, присутствующего в крови, переносится молекулами гемоглобина. Этот процесс зависит от присутствующей в эритроцитах карбоангидразы, которая катализирует превращение поступающего из тканей СО2 в угольную кислоту. Последняя быстро и спонтанно диссоциирует на бикарбонат-ион и протон.
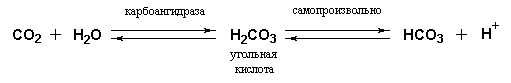
Для предотвращения опасного понижения рН в крови должна существовать буферная система, способная поглощать избыток протонов. Эту функцию также выполняет гемоглобин, который связывает два протона на каждые четыре освободившиеся молекулы кислорода и, тем самым, определяет буферную емкость крови.
В легких идет обратный процесс: присоединение кислорода к дезоксигемоглобину сопровождается высвобождением протонов, которые связываются с бикарбонат-ионами с образованием угольной кислоты. Эффективно действующая карбоангидраза катализирует превращение угольной кислоты в углекислый газ, выдыхаемый из легких.
Окисление ферро-(Fe2+)-формы железа гема в ферри-(Fe3+)-форму приводит к образованию метгемоглобина – функционально неактивной формы гемоглобина, лишенной возможности связывать кислород. Обычно в эритроцитах накапливается до 1% метгемоглобина в сутки, что связанно с обычным процессом автоокисления оксигемоглобина. Восстановление гемового железа до ферро-(Fe2+)-формы осуществляется NADH-метгемоглобинредуктазой, которая ответственна за поддержание низкого уровня физиологически неактивной формы гемоглобина в красных кровяных клетках. Вторым продуктом автоокисления гемоглобина являются высокоактивные супероксидные анионы – О2 · ¯, которые служат субстратом для супероксиддисмутазы, обеспечивающей прерывание цепи генерирования свободных радикалов в эритроцитах.
Выделение гемоглобина
Гемоглобин является наиболее доступным для лабораторного изучения гемопротеидом. Этот белок выделяют из эритроцитов после их лизиса при добавлении дистиллированной воды, эфира или толуола. В гипотонической среде эритроциты набухают, лизируются и гемоглобин переходит в водный раствор. Эфир способствует растворению липидной оболочки эритроцитов, что облегчает выход их содержимого в раствор. Отделение белков плазмы достигается их осаждением полунасыщенным раствором сульфата аммония. После центрифугирования раствора и удаления осадка в супернатанте происходит медленная кристаллизация гемоглобина, которую осуществляют в течение длительного времени (около суток) на холоду.
Цитохромы
Цитохромы – сложные железосодержащие белки, относящиеся к гемопротеидам, простетическая группа которых представлена гемом. Цитохромы широко распространены в растительных и животных клетках и микроорганизмах (дрожжах, аэробах и некоторых факультативных анаэробах) и связаны с мембранами митохондрий, эндоплазматического ретикулума, хлоропластов и хроматофоров. Они играют важную роль во многих процессах, протекающих в живых организмах, – клеточном дыхании, фотосинтезе, микросомальном окислении. Все цитохромы способны отдавать и принимать электрон путём обратимого изменения валентности атомов железа, входящих в состав гема. Объединённые в короткие или длинные цепи (в зависимости от величины потенциала конечного акцептора электронов) цитохромы переносят электроны от дегидрогеназ к конечным акцепторам. Передача электронов от цитохрома к цитохрому позволяет клетке использовать энергию химических соединений или солнечного света в энергетических или пластических целях. Так, в составе цепи дыхательных ферментов митохондрий цитохромы при участии цитохромоксидазы осуществляют конечные этапы окисления субстратов кислородом. Освобождающаяся при этом энергия утилизируется для образования АТР или в виде мембранного потенциала. Цитохромы эндоплазматического ретикулума являются частью системы, осуществляющей обмен и обезвреживание ароматических соединений-ксенобиотиков.
По спектральным характеристикам, химическому строению боковых цепей гема и природе связи гема с белковой частью этих гемопротеидов цитохромы подразделяют на 4 типа: а, b, с, d. Каждый из них, в свою очередь, включает несколько видов цитохромов, например, цитохром c1. В восстановленном состоянии абсолютные спектры цитохромов имеют три выраженные полосы поглощения, характерные для каждого типа цитохромов и позволяющие определять их содержание методом спектрофотомерии. Получение высокоочищенных цитохромов затруднено тем, что они прочно связаны с мембранами и отделяются только при обработке поверхностно-активными веществами или протеолитическими ферментами. Исключение составляют цитохромы b3 и с (рис. 3.5), легко экстрагируемые из мембран солевыми растворами.

Рис. 3.5. Структура цитохрома с
Не нашли, что искали? Воспользуйтесь поиском: