
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Заповнення підрівнів по періодах періодичної системи
| Періоди | Малі | Великі | |||||
| I | II | III | IV | V | VI | VII | |
| Підрівні, що заповнюють- ся (валентна оболонка) | 1 s | 2 s 2 p | 3 s 3 p | 4 s 3 d 4 p | 5 s 4 d 5 p | 6 s 4 f 5 d 6 p | 7 s 5 f 6 d |
Запам'ятайте перевірений вами порядок. Кожен період починається з заповнення s- підрівня зовнішнього електронного рівня, а завершується заповненням його p -підрівня. Виключення складає лише перший період, у якому заповнюється тільки підрівень 1 s.
Орбіталі того самого підрівня, що мають під час відсутності зовнішніх електричних і магнітних полів однакову енергію, заповнюються у відповідності з правилом Хунда. За цим правилом сумарний спін електронів має бути максимальним. Це означає, що орбіталі підрівня заповнюються електронами спочатку по одному і при однаковій орієнтації спінів.
У залежності від того, який підрівень останнім заповнюється електронами, всі елементи поділяють на чотири електронні сімейства: s -, p -, d - і f-.
При складанні електронних формул корисно користуватися узагальненими формулами для електронних сімейств (табл.4).
Таблиця 4
| Електронні сімейства елементівЕлектронне сімейство | Положення в періодичній таблиці | Коротка електронна формула |
| s - сімейство р - сімейство d - сімейство f – сімейство | головні підгрупи I - II груп і елемент He головні підгрупи III - VIII груп (виключаючи He) побічні підгрупи I-VIII груп лантаноїди та актиноїди | n s 1-2 ns 2 np 1-6 ns 2(n – 1) d 1-10 ns 2(n – 1) d 1(n -2) f 1-14 |
Вчення про хімічний зв’язок є важливою проблемою сучасної хімії. Знаючи його природу в сполуках, можна робити висновки про будову і фізико-хімічні властивості цих сполук. Згідно з квантово-механічними уявленнями, даному просторовому положенню атомів у молекулі, йоні чи кристалі відповідає певний розподіл електронної густини.
Залежно від характеру розподілу електронної густини між атомами розрізняють три основні типи хімічногозв’язку: ковалентний, йонний і металічний. Крім вказаних видів, між молекулами можуть існувати водневий зв’язок і сили Ван-дер-Ваальса.
Для описання ковалентного зв’язку сьогодні найчастіше використовуються два методи: метод валентних зв’язків (ВЗ) і метод молекулярних орбіталей (МО).
Метод валентних зв’язків
В основі методу ВЗ лежать такі положення:
1. Зв’язок між атомами є двоцентровим і двоелектронним. Це означає, що ковалентний зв’язок між двома атомами утворюється двома електронами (спільною електронною парою) з протилежно направленими спінами. Утворення спільної пари розглядається як результат перекривання електронних хмаринок (орбіталей) з неспареними електронами.
2. Зв’язок буде тим міцніший, чим повнішим є перекривання електронних орбіталей, що взаємодіють між собою.
Для наочного зображення хімічного зв’язку у методі ВЗ використовують різні способи:
а) льюїсівські формули, де валентні електрони позначають крапками (приклад 1а);
б) графічні формули, в яких хімічний зв’язок (спільну електронну пару) позначають рискою (приклад 1б);
в) за допомогою енергетичних комірок (приклади 1в, 2);
г) орбітальні діаграми, в яких схематично показують перекривання електронних хмаринок (орбіталей) атомів, що взаємодіють між собою (приклади 1г, 2).
Метод ВЗ, в основному, пояснює природу ковалентного зв’язку.
Ковалентний зв’язок та його різновидності
Ковалентний зв’язок – це зв’язок, який здійснюється спільною електронною парою:
1) залежно від положення спільної електронної пари між атомами ковалентний зв’язок може бути:
– неполярний (електронна пара знаходиться на однаковій відстані між ядрами атомів);
– полярний (електронна пара зміщена в бік електронегативнішого елемента). Перший випадок спостерігається, коли зв’язок утворюється між однаковими атомами, другий – між різними атомами (див. приклад 3);
2) залежно від механізму утворення спільної електронної пари ковалентний зв’язок може бути:
– простий ( утворений за обмінним механізмом, коли для утворення кожного зв’язку атоми віддають по одному неспареному електрону і зв’язок утворюється при перекриванні одноелектронних хмаринок);
– донорно-акцепторний (утворений за донорно-акцепторним механізмом, коли для утворення зв’язку один атом віддає пару електронів, а інший – вакантні орбіталі для неї (приклад 4);

В йоні NH4 зберігаються 3 ковалентні зв’язки N – H, що були у молекулі NH3. Четвертий ковалентний зв’язок утворюється за донорно-акцепторним механізмом: для утворення цього зв’язку аміак віддає неподілену електронну пару, а йон Н+ (протон) – вакантну орбіталь. Тут NH3 – донор, йон Н+ – акцептор.
3) залежно від характеру перекривання електронних хмаринок розрізняють:
s-зв’язок (електронні хмаринки перекриваються на прямій, що з’єднує ядра атомів);
p-зв’язок (перекривання електронних хмаринок здійснюється перпендикулярно до прямої, що з’єднує ядра атомів (приклад 1г).
Ковалентністю атома називають здатність атома утворювати певну кількість зв’язків (спільних електронних пар) з іншими атомами.


В цих молекулах ковалентність атомів водню і фтору дорівнює 1, а азоту – 3;
б) графічні формули:
Н – Н, F – F, 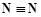 , H – F;
, H – F;
в) за допомогою квантових комірок

Зв’язок утворюється тільки при взаємодії (перекриванні) орбіталей, що містять неспарені електрони з протилежними спінами;
г) орбітальні діаграми.
Цей спосіб дає змогу визначити направленість зв’язку і геометричну форму утвореної молекули.Кількість електронних хмаринок, що беруть участь в утворенні зв’язків, і їх форму (тип) для кожного атома визначають на підставі даних про утворення зв’язків за допомогою квантових комірок (п. в). Видно, що при утворенні молекули Н2 перекриваються дві s-орбіталі, F2 – дві р-орбіталі, N2 – шість р-орбіталей (по три у кожного атома азоту); HF – s-орбіталь атома водню і р-орбіталь атома фтору. Знаки «+» і «-» на орбіталях означають знаки амплітуди хвильової функції y, що описує рух електрона. Зв’язок утворюється, якщо перекриваються орбіталі з однаковими знаками амплітуд хвильових функцій.
Між атомами Н2; F2 i HF відбувається перекривання електронних хмаринок тільки на прямій між ядрами атомів.
Отже,утворюється тільки s-зв’язок. У молекулі N2 існують три зв’язки. На лінії, що з’єднує ядра атомів (вісь х), орбіталі перекриваються з утворенням s-зв’язку. По осях у і z перекривання орбіталей здійснюється перпендикулярно до прямої, що з’єднує ядра атомів – утворюються дваp-зв’язки, значно слабші за s-зв’язки.
Перекривання АО у молекулі

Гібридизація – це змішування різних за формою і енергією орбіталей атома, остаточним результатом якого є така ж кількість, але рівноцінних за формою і енергією, гібридних орбіталей.
У атома Ве у збудженому стані вступають у гібридизацію (зміщування) одна s- і одна р-орбіталі з неспареними електронами і дають дві рівноцінні
sр-гібридні орбіталі, розміщені під кутом 180° (положення, в якому найслабше діють між ними сили відштовхування):

Утворені sр-гібридні орбіталі атома Ве перекриваються з р-орбіталями атома фтору.

Полярні зв’язки утворюються тоді, коли між собою з’єднуються різні атоми, наприклад, у молекулах Н2О, НСІ, NH3 і інші.
Спільна електронна пара, в цьому випадку, зміщується в бік електронегативнішого атома (такого, що має більше значення відносної електронегативності (ВЕН)).

Наприклад:
 полярний зв’язок
полярний зв’язок
В йоні NH4 зберігаються 3 ковалентні зв’язки N – H, що були у молекулі NH3. Четвертий ковалентний зв’язок утворюється за донорно-акцепторним механізмом: для утворення цього зв’язку аміак віддає неподілену електронну пару, а йон Н+ (протон) – вакантну орбіталь. Тут NH3 – донор, йон Н+ – акцептор.
Металічний зв’язок
Металічний зв’язок існує, в основному, у кристалах металів і утворюється «спільними» електронами, що вільно рухаються в об’ємі кристалічної ґратки між атомами і йонами металу, що утворилися при відриві електронів від атомів. Водневий зв’язок
Водневий зв’язок, на відміну від розглянутих вище типів хімічних зв’язків, є міжмолекулярним зв’язком. Він утворюється між електронегативним елементом (F,O,N) одної і позитивно поляризованим атомом водню іншої молекули:
Хб– - Нб +... У б - –, де Х і У – атоми О, N або F.
Водневий зв’язок на порядок слабший за ковалентний, але відіграє дуже важливу роль. Саме завдяки водневому зв’язку вода у звичайних умовах є рідиною, існує впорядкованість і структура білкових систем тощо.
Крім водневого зв’язку, до міжмолекулярних сил взаємодії належать йон-йонні, йон-дипольні, диполь-дипольні та дисперсійні сили. Диполь-дипольні та дисперсійні сили часто об’єднують під одною назвою вандерваальсові сили.
Питання для самоперевірки
1.Ща таке хімічний зв’язок?
2.У чому сутність ковалентного зв’язку?
3.Що таке водневий зв’язок, привести приклади?
4.Вкажить вид хімічного зв’язку в таких сполуках: Н2, СО2, І2. Відповідь обґрунтуйте.
5.Складіть рівняння реакції між простими речовинами, утвореними елементами з порядковими номерами 1 і 9. Який тип хімічного зв’язку має утворена сполука?
Не нашли, что искали? Воспользуйтесь поиском: