
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Анализ кинетики окисления сульфидов
(4 часа)
1. ЦЕЛЬ РАБОТЫ
Анализ кинетики процесса окисления сульфидов.
2. ТЕОРЕТИЧЕСКОЕ ВВЕДЕНИЕ
Процесс окисления сульфидов в твердом состоянии весьма распространен в металлургии цветных металлов и имеет техническое название обжиг. Обжиг в большинстве технологических схем производства меди, цинка, свинца, вольфрама, молибдена и других металлов - это первая металлургическая операция после обогащения сырья. Необходимость обжига в различных схемах диктуется разными причинами, но главная цель - перевод части компонентов сульфидного сырья в оксидную форму.
Для окисления сульфидов используется несколько видов реакторов, наибольшее распространение получили печи кипящего слоя. Не вдаваясь в детали их конструкции, отметим, что это аппараты, обеспечивающие практически идеальное перемешивание, где каждая частица сырья интенсивно омывается потоком воздуха (рисунок 3.1). При достаточно высоких температурах сульфиды металла, взаимодействуя с кислородом воздуха, переходят в другие соединения (оксиды, сульфаты, сульфиты и металлы).
МеS +3/2 O2 = МеО + SO2 (1)
MeS + 2O2 = MeSO4 (2)
MeS + О2 = Me + SO2 (3)
MeS + 3/2 O2 = MeSO3 (4)
Целью анализа является моделирование этого процесса и предсказание его параметров при различных условиях..
При обжиге чаще всего параметром, который необходимо предсказать в тех или иных условиях, является степень удаления серы в газовую фазу. Подстепенью удаления серы понимается отношение массы серы в газовой фазе к массе ее в исходном сырье


В различных курсах металлургии и на практике можно встретить другие названия этого параметра или тесно связанные с ним
• десульфуризация (степень десульфуризации),
• процент серы перешедшей в газовую фазу,
• степень протекания реакции,
• извлечение серы в газ
Процесс обжига характеризуют следующие показатели:
М3 - масса загрузки печи, кг;
Vд - поток дутья, мЗ/с,
%О2д - доля кислорода в дутье (для воздуха % О2д =21),
d - крупность материала, мм,
Т - температура процесса, К,
Р - общее давление, бар, (1 бар = 1 атм = 105 Па = 760 мм рт. ст.)
t - время, с
Итак, необходимо в зависимости от заданных условий надо предсказать значение DS. Для этого необходимо иметь систему уравнений, связывающих Ds с условиями плавки. Поскольку реакции (1) - (4) протекают во времени, значение Ds также постоянно изменяется. Поэтому для описания кинетики применяют системы обыкновенных дифференциальных уравнений, в которых вое производные берут по времени. Для того чтобы записать эти дифференциальные уравнения, необходимо, во первых, определить их структуру, т.е. выяснить какие процессы мы должны описать химические реакции, внешнюю или внутреннюю диффузию, тепло- или массоперенос, - во-вторых, подобрать коэффициенты этих уравнений в зависимости от их структуры, это могут быть коэффициенты диффузии порядки реакций, энергии активации и т. п. И для первого и для второго требуется провести эксперимент и получить кинетические кривые
Кроме того, чтобы составить модель процесса необходимо определить лимитирующую стадию, так как в многостадийном процессе его кинетику определяет самая медленная (лимитирующая) стадия. В общем случае в гетерогенных процессах наблюдаются следующие стадии (см рис. 32)
1 - подвод реагента из объема и поверхности твердого тела (внешний массоперенос),
2 - адсорбция реагента на поверхности твердого тела,
3 - диффузия реагента сквозь слой продуктов (внутренняя диффузия),
4 - одна или несколько химических реакций (кинетическая стадия),
5 - отвод реагентов сквозь слой продуктов (внутренняя диффузия),
6 - десорбция газообразных продуктов,
7 - отвод газообразных продуктов в объем реактора (внешний массоперенос),

Скорость каждой из этих стадий описывается своим дифференциальным уравнением.
Скорость внешнего массопереноса определяется скоростью подачи газообразного. реагента и физическими свойствами газов
 β
β 
где: S - площадь частицы, м, β - коэффициент массопереноса, моль/(м2 с), c0 - концентрация окислителя в объеме, сn - концентрация окислителя на поверхности частицы. Скорость адсорбции зависит от температуры, парциального и равновесного давлений реагента и от физического состояния поверхности, которое влияет на так называемый коэффициент прилипания.

где: α - коэффициент прилипания, который численно равен доле газообразных молекул, которые ударились о поверхность твердого тела и прилипли, по отношению к общему числу ударившихся молекул, Т - температура, К; К - константа скорости адсорбции, моль К/с м, численные значечия с0 и сn совпадают с давлением, измеренным в атмосферах.
Скорость внутренней диффузии определяется первым законом Фика

Где: D - коэффициент диффузии, моль/(с∙м); r - текущий радиус частицы, м, r0 - начальный радиус частицы, м, Сгр - концентрация вещества на границе раздела сульфид-оксид.
Скорость химической реакции зависит от температуры, давления газообразного реагента и площади поверхности раздела фаз
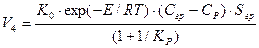
где: Е - энергия активации, Дж/моль, К0- константа скорости реакции, моль/(с м2); К - константа равновесия реакции, Sгр - площадь границы раздела фаз сульфид - оксид, м, ср - равновесная концентрация
Как видно из приведенных законов (5)-(8), скорости разных стадий зависят от различных факторов. Поэтому для определения лимитирующей стадии поступают следующим образом.
На основании экспериментальных данных строят кинетические кривые процесса при разных условиях и анализируют, какие факторы существенно влияют на его скорость, и таким образом определяют лимитирующую стадию процесса. Например, если выясняется, что температура сильно повышает скорость реакции, то можно сделать вывод что кинетику определяет закон (8) и лимитирующей стадией является химическая реакция. Если же с ростом температуры скорость падает, то кинетика описывается законом (6) и лимитирующей стадией является адсорбция. Аналогичные рассуждения проводятся для других факторов давления, потока газа и времени. После определения лимитирующей стадии для составления модели процесса используется то уравнение, которое описывает эту стадию.
Рассмотрим построение модели процесса обжига для того случая, когда лимитирующей стадией является химическая реакция. В этом случае основное уравнение модели имеет вид
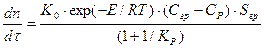 (5)
(5)
где: dn/dt – скорость процесса, моль/с
Для того чтобы воспользоваться уравнением (5) необходимо оценить константы K0 и Е. Методов определения этих констант много. Например, Е можно рассчитать, определив экспериментально скорость процесса при разных температурах и одной и той же степени протекания его. Тогда, сделав преобразования, уравнение (5) можно записать в виде
V1=K1∙exp(E/RT1) (6)
V2=Kl∙exp(-E/RT2) (7)
где: V1 и V2 - скорости при температурах T1 и Т2,

Отсюда видно, что для нахождения Е достаточно решить систему уравнений (6), (7).
В работе способ нахождения нужных физических констант студенты предлагают сами после определения лимитирующей стадии. После определения численного значения физических констант можно приступить к разработке полной модели.
Равновесную концентрацию кислорода (ср) определяем из реакции
3 FeS + 3/2 O2 - FeO + SO2,

Так как в нашем случае FeO и FeS получались в конденсированном виде, их активности равны единице. Отсюда
Ср=[Pso2/Кр]2/3 (8)
Давление S02 в открытой системе практически совпадает с содержанием кислорода в исходном дутье, т.е в уравнении (12) Pso2 =0.2. Тогда равновесную концентрацию Ср можно рассчитать, используя справочные данные для Кр.
Второе дифференциальное уравнение должно описывать изменение Sгр(τ). Для того чтобы составить это уравнение, проведем следующие рассуждения.
Пусть радиус неокислившейся частицы равен r(τ), тогда
S (τ)=4∙π∙[r(τ)]2 (9)
Объем частицы
V(τ)= 4/3∙π∙[r(τ)]3 (10)
Число молей частицы
n(τ)=V(τ)/Vm (11)
где: Vm- молярный объем
Таким образом, используя зависимости (9) - (11), получим
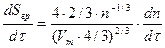
Итак, моделью исследуемого процесса является система из двух дифференциальных уравнений
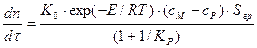
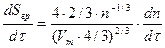
3. АППАРАТУРА
Измерение тепловыделения экзотермической реакции окисления сульфидов в условиях, приближающихся к изотермическим, осуществляется дифференциальной термопарой, которая представляет собой две обычные последовательно спаянные одноименной проволокой, и регистрируется микровольтамперметром фотокомпенсационного типа Ф116 и автоматическим самопишущим потенциометром ПСР-03. 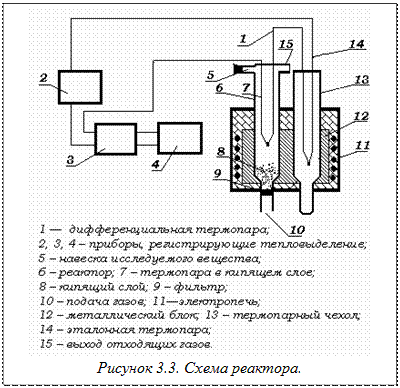
Установка содержит кварцевый реактор 6 с кварцевым фильтрам 9, где создается кипящий слой материала. Термопара 7 вставляется в реактор таким образом, чтобы горячий спай ее находился на определенном расстоянии от фильтра в кипящем слое материала. Горячий спай термопары 13 помещен вэталон - вещество, которое не испытывает термических превращений в исследуемом интервале температур
Для обеспечения стабильности теплового режима работы реактор и эталон находятся в стальном блоке 11, помещенном в трубчатую печь 10. В реактор подается воздух или смесь кислорода и азота в заданных соотношениях
4. ПЛАНИРОВАНИЕ ЭКСПЕРИМЕНТА
В теоретическом введении перечислено 7 условий проведения процесса. На одно из них - время - невозможно повлиять, мы можем лишь фиксировать изменение параметров системы во времени. Остальные же 6 условий могут произвольно задаваться. Однако из этих шести условий два общее давление Р и содержание кислорода в воздухе (%О2) - остаются практически одинаковыми для любых процессов, таким образом, вряд ли необходимо проводить эксперименты при разных Р и (%02), так как в эксперименте и на практике эти параметры совпадают.
Четыре параметра М3, Vд, d и Т - могут принимать различные значения Но среди них два. H3 и Vд влияют на основной параметр DS нераздельно. Действительно, DS - это доля серы перешедшая в газ, т.е.DS относительная величина. Очевидно, при увеличении М3 и Vд в п раз Ds за одно и то же время эксперимента будет одинаковым. Другими словами, Ds зависит от отношения М3/Vд. Поэтому из этих двух параметров в ходе эксперимента можно изменять лишь один. Понятно, что проще задавать навеску, чем расход воздуха.
Итак, для составления плана нам необходимо выбрать уровни для трех факторов М3, d и Т.
Этот выбор студенты должны осуществить самостоятельно, исходя из следующих соображении
• можно ли фактор изменять непрерывно или дискретно;
• является ли предлагаемая зависимость скорости процесса от фактора простой или сложной;
• трудно ли задавать значение фактора;
• широк ли диапазон его изменения.
5. ПОРЯДОК ПРОВЕДЕНИЯ РАБОТЫ И УКАЗАНИЯ ПО ТЕХНИКЕ БЕЗОПАСНОСТИ
1. На основании планирования эксперимента выбрать условия проведения процесса.
2. Взять навеску исследуемого сульфида металла.
3. С помощью ситового анализа определить размер частиц на разделение на определенные фракции.
4. По данным ситового анализа построить ситовую характеристику, с помощью которой определить массу нужной фракции.
5. Установить определенный расход газа.
6. Включить нагреватель печи и с помощью трансформатора установить заданную температуру. Диапазон температур 600- 900 °С.
7. При достижении постоянства сигнала дифференциальной термопары, когда стрелка зеркального гальванометра находится на нуле, навеску исследуемого сульфида быстро высыпать в реактор. При окислении сульфида температура в реакторе повышается на 2-5 °С, что регистрируется термопарой и записывается в виде термограмм на самопишущем приборе ПСР-03.
При работе на установке необходимо соблюдать правила безопасной работы с печами сопротивления Заправка диаграммной ленты в прибор ПСР производится студентом в присутствии лаборанта.
6. ОБРАБОТКА РЕЗУЛЬТАТОВ
1. Определить лимитирующую стадию процесса.
2. Определить физические константы.
3. Построить полную модель процесса.
4. Предсказать возможные параметры процесса, предложенного преподавателем, используя разработанную модель.
7. ТРЕБОВАНИЯ К ОТЧЕТУ
Отчет должен содержать:
1. Краткое теоретическое введение.
2. План эксперимента и схему экспериментальной установки.
3. Выбранные условия проведения процесса (табл. 3.1) и результаты эксперимента (табл. 3.2).
4. Определение лимитирующей стадии процесса и кинетических констант.
5. Модель в виде системы дифференциальных уравнений.
6. Параметры технологического процесса обжига, предсказанные на основании решения дифференциальных уравнений.
Таблица 3.1 -Условия проведения эксперимента
| N | М3,г | d,мм | Т,°С |
Таблица 3.2- Экспериментальные данные
| Номер опыта | Время t,мин | Степень протекания |
| … |
8. ЛИТЕРАТУРА
Ванюков А.В, Зайцев В.Л. Теория пирометаллургических процессов - М-Металлургия, 1993 С 275 - 285
9. КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Каков физический смысл зависимости константы скорости реакции от температуры?
2. Каков физический смысл зависимости константы скорости от крупности материала?
3. Каков физический смысл порядка реакции?
4. Каков физический смысл энергии активации?
5. Как определить время периодов индукционного, автокаталитического и усредненного фронта?
6. Каков физический смысл зависимости энергии активации от температуры?
7. Какие рекомендации можно предложить по интенсификации этого процесса?
8. Как определить качество окалины (рыхлая, пористая, плотная)?
9. Как вывести уравнение для расчета энергии активации?
10. Как можно записать уравнение связи между количеством выделившегося тепла Q и массой прореагировавшего вещества М?
Не нашли, что искали? Воспользуйтесь поиском: