
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Лабораторна робота №7
Хроматографічний аналіз вуглеводневих газів
7.1 Мета і завдання
Метою роботи є набуття студентами теоретичних і практичних навичок з аналізу вуглеводневих газів за допомогою хроматографічного методу.
При виконанні цієї роботи перед студентами ставиться завдання
- вивчити принципову схему хроматографа;
- навчитися розшифровувати хроматограми.
7.2 Загальні положення
Сучасна геологія і геохімія нафти і газу широко використовує різні фізичні та фізико - хімічні методи дослідження при веденні пошуків, розвідки і розробки родовищ нафти і газу. Одним з них є хроматографічний.
Швидкий розвиток хроматографічного методу пояснюється його виключно широкими можливостями. Він дозволяє аналізувати макрокількості і мікрокількості газів достатньо летких речовин за дуже короткий час.
Природні гази і, особливо, нафти є складними сумішами, що складаються від декількох до сотень тисяч окремих сполук, аналіз яких став можливим лише з розвитком хроматографії.
Газова хроматографія - це метод аналізу складних речовин в газовій або парогазовій фазі шляхом розділення їх на індивідуальні компоненти або окремі групи. Сучасна апаратура дозволяє аналізувати не тільки гази, але і вуглеводневі сполуки з числом вуглецевих атомів в молекулі до 100.
Хроматографи випускаються різних конструкцій для різноманітних цілей, але всі вони мають багато спільного.
Принципова схема газового хроматографа зображена на рисунку 7.1. Газ - носій, що знаходиться в балоні (1), в процесі аналізу проходить через всі частини газової схеми приладу. В його потік вводиться газ, що підлягає аналізу, з допомогою спеціального дозатора (2) (або шприца). Газ - носій разом з пробою проходить через хроматографічну колонку (3) і потрапляє на детектор (аналізатор) (4). З детектора (аналізатора) поступають сигнали на реєстратор (5), де ведеться запис даних на діаграму або числовий пристрій.
В газовій хроматографії використовується властивість молекул індивідуальних газів по різному адсорбуватись (утримуватись) на поверхні твердих тіл або абсорбуватись (розчинятись) в тонкому поверхневому шарі рідини (явища сорбції). Зворотній процес називається десорбцією.
Здатність адсорбувати молекули газу характерна для всіх твердих тіл, а особливо для тих, що мають тонку структуру і відповідно, велику поверхню. Такими адсорбентами є деревне вугілля, силікагель, алюмогель, молекулярні сита спеціальні сорти цегли та ін.
Уявімо собі поверхню адсорбенту над яким знаходиться газ, що складається з декількох компонентів, які мають різну адсорбційну здатність до даного адсорбенту. У кожний момент частина молекул кожного компоненту адсорбується на поверхні адсорбенту, а інша частина знаходиться в газовому стані. Адсорбовані молекули зазнають коливних рухів і тим інтенсивніших, чим вища температура. При певних умовах вони, перемігши адсорбційні сили, відриваються і переходять в газову фазу. В той же час інші молекули, наблизившись до поверхні, можуть прилипнути до неї зайнявши вільне місце. Таким чином, одночасно відбувається адсорбція і десорбція. З підвищенням температури рівновага зміщується в бік десорбції. Різні компоненти газу мають різну адсорбційну здатність, тому кількість адсорбованих і тих, що знаходяться в газовій фазі, буде різна для кожного компоненту.

Саме ці явища і складають основу хроматографічного методу аналізу складної суміші.
Хроматографічне розділення суміші газів на індивідуальні компоненти досягається в процесі руху (фільтрації) через колонку (трубку), яка заповнена сорбентом (твердим, подрібненим або рідким), що нанесений на носій. Введена проба досліджуваного газу просувається в колонці газом - носієм (азот, аргон, гелій та ін.), що постійно тут протікає.
Припустимо, що досліджуваний газ складається з компонентів А, Б, В, а компонент А має таку сорбованість, що одна половина його знаходиться на сорбенті (тобто нерухома), а друга половина рухається з газом - носієм. Ті молекули, що на сорбенті, будуть відставати на час який вони є в стані,,спокою”. Оскільки всі молекули безперервно як би міняються місцями, то кожна з них за деякий певний час буде рухатись тільки половину того часу і результативна їх швидкість буде в два рази менша за швидкість газу - носія.
Інші гази мають іншу сорбованість, отже будуть виходити за інший час. Цей процес хроматографічного розділення наглядно показаний на рис. 7.2, де показано колонку в різні проміжки часу від впуску проби (а) до повного розділення (г) всіх трьох компонентів А, Б, В. В проміжках між ними як і разом з ними буде виходити газ - носій.

Розділений на компоненти досліджуваний газ потрапляє на детектор. Детектор - це пристрій, який дозволяє фіксувати яку-небудь фізико-хімічну властивість бінарної суміші, що визначається її складом.
Існують різні детектори: по теплопровідності, по теплоті згорання (термохімічний), іонозаційно - полум'яний та інші. Перший з них працює на реєстрації різниці теплопровідності компоненту досліджуваного газу і газу - носія. Чим вища концентрація компоненту, тим більший буде пік. Детектор добре працює при макроконцентраціях і при великій різниці теплопровідностей газу-носія і досліджуваного газу. В другому використовується ефект теплоти згорання компонентів проби в атмосфері повітря або кисню. Часто перегорають платинові нитки. Чутливість його вища за детектор по теплопровідності.
Для дослідження вуглеводневих (горючих) газів широко використовується іонозаційно - полуменевий детектор, який дозволяє фіксувати мікроконцентрації ВВ біля 10 –6 %. Відомо, що гази при звичайних умовах не проводять струму, але під дією полум'я в газі виникають іони і він стає провідником струму. Це відбувається при згоранні вуглеводневих газів. Зміну іонного струму легко виміряти. На цьому і базується іонозаційно - полуменевий детектор. Горіння відбувається в полум'ї водню.
В результаті аналізу з детектора поступають сигнали, які записуються на стрічці у вигляді кривих. Ця крива запису - хроматограма у вигляді цілого ряду піків тієї чи іншої величини. Кожному компоненту проби газу буде відповідати один пік. Завдання визначити, який пік якому компоненту відповідає. Якщо про пробу газу нам абсолютно нічого невідомо, то хроматограму без інших видів аналізу розшифрувати практично неможливо.
При аналізі природних газів крім N2, О2, CO2, інертних газів можуть бути присутні вуглеводневі гази, що найбільш цікавлять при пошуках, розробці покладів нафти і газу. На основі досвіду та теорії відомо, що вуглеводневі гази метанового ряду виділяються з хроматографічної колонки в порядку зростання їх температури кипіння, тобто в міру збільшення кількості атомів вуглецю в молекулі. Тому порядок виходу буде такий: метан, етан, пропан, і - бутан, n - бутан, і - пентани, n - пентан, а потім гексани і т. д.
Якщо в газах присутні ще ненасичені вуглеводні то після кожного насиченого буде виходити його ненасичений аналог (тією ж кількістю атомів вуглецю). Отже будемо мати вихід такий: метан CH4, етан C2H6, етилен C2H4, пропан C3H8, пропілен C3H6, і - бутан C4H10 і n - бутан C4H10, бутілени C4H8 і т.д.
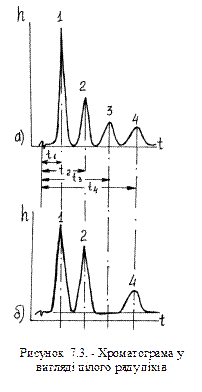
Хроматограф регулюють таким чином, що час виходу кожного компоненту залишається постійним в кожній пробі незалежно від її складу. В цьому легко переконатись з двох хроматограм наведених на рис. 7.3. На верхній хроматограмі суміш складається з чотирьох компонентів (1 - метан, 2 - етан, 3 - пропан, 4 - бутан). На нижній хроматограмі відсутній третій компонент (пропан), але час виходу кожного компоненту залишився попереднім.
Час виходу кожного компоненту газу встановлюється експериментально за відомими еталонними сумішами або при індивідуальному введенні в хроматограф кожного компоненту.
Таким чином, якісний склад (назва) компонентів газової проби визначається за часом виходу.
Кількісний вміст переважно визначають шляхом калібрування відомими сумішами і вирахування відповідних коефіцієнтів. Основою кількісного розрахунку хроматограм є площа (іноді висота) піків. В хроматографії встановлена лінійна залежність площі піка від концентрації компонента в достатньо широких межах концентрацій.
Не нашли, что искали? Воспользуйтесь поиском: