
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Количество энергии, выделяющейся при образовании химической связи, называется энергией связи. Чем больше энергия связи, тем она прочнее.
Рассмотренный механизм возникновения ковалентной связи путем обобществления неспаренных электронов двух атомов получил название обменного механизма. Возможен и другой механизм ее образования – донорно-акцепторный. В этом случае ковалентная связь возникает за счет пары электронов одного атома и свободной орбитали другого атома.
 Рассмотрим образование связи по донорно – акцепторному механизму при взаимодействии молекулы аммиака с ионом водорода: NH3 + H+ → NH4+
Рассмотрим образование связи по донорно – акцепторному механизму при взаимодействии молекулы аммиака с ионом водорода: NH3 + H+ → NH4+
При возникновении молекулы NH3 в образовании связей принимают участие неспаренные электроны атомов азота и водорода:
 |
В молекуле аммиака атом азота имеет неподеленную пару электронов.
У иона водорода свободна (не заполнена) 1s – орбиталь:
 |
При сближении молекулы аммиака и иона водорода пара электронов азота переходит на свободную орбиталь катиона водорода в результате чего образуется четвертая ковалентная связь. По свойствам четвертая связь в ионе аммония ничем не отличается от остальных трех.
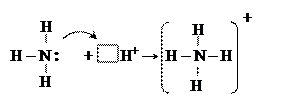 Образование иона аммония можно представить следующей схемой:
Образование иона аммония можно представить следующей схемой:
 |
Атом азота в молекуле аммиака является донором, а ион водорода – акцептором.
Образованная таким путем ковалентная связь называется донорно - акцепторной или координационной связью.
Не нашли, что искали? Воспользуйтесь поиском: