
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Свойства ковалентной связи
Насыщаемость и направленность. Под насыщаемостью понимают способность атомов образовывать строго ограниченное число связей. Например, атом водорода (имеющий в наличии один неспаренный электрон) способен образовывать только одну связь. Именно насыщаемость связей определяет состав той или иной молекулы: Н2, НСI и т. д. То количество связей, как по донорно-акцепторному, так и по обменному механизму, которое образует атом элемента, соединяясь в молекулу определенного состава, называют валентностью элемента, например:
Согласно изложенных положений метода валентных связей, валентность элементов определяется числом содержащихся в атоме неспаренных электронов. Для s- и p-элементов – это электроны внешнего уровня, для d-элементов – внешнего и предвнешнего уровней.
Однако во многих случаях количество неспаренных электронов, которыми обладает атом в основном состоянии, значительно меньше числа ковалентных связей, образуемых этим атомом.
Последнее объясняется возможностью перехода атома в возбужденное состояние. Вступающие в реакцию атомы способны поглощать энергию извне (при нагревании, облучении) и возбуждаться. В возбужденном атоме спаренные электроны могут разъединяться и переходить на свободные орбитали более высоких энергетических подуровней того же энергетического уровня (переход на какой-либо иной уровень невозможен). В результате, общее число неспаренных электронов увеличивается, а энергия, затрачиваемая на возбуждение атома, с избытком компенсируется впоследствии за счет образования дополнительных химических связей с другими атомами.
Валентность элементов главной подгруппы I группы равна единице, так как на внешнем уровне атомы этих элементов имеют один электрон:
Li 2s1 B = 1; Na 3s1 B = 1 и т. д.
Валентность элементов главной подгруппы II группы в основном (невозбужденном) состоянии равна нулю, так как на внешнем уровне нет неспаренных электронов. При возбуждении этих атомов спаренные s-электроны разъединяются и один из них переходит на свободную орбиталь p-подуровня этого же уровня, валентность при этом становиться равной двум (возбужденный атом отмечен звездочкой):
1s22s2 Ве; 1s22s12p1 Be*
Кислород и фтор во всех соединениях проявляют постоянную валентность, равную соответственно двум и единице. Валентные электроны этих элементов находятся на втором энергетическом уровне, где нет больше свободных орбиталей:
О 1s22s22pх22py12pz1 валентность равна 2
F 1s22s22pх22py22pz1 валентность равна 1
В то же время сера – аналог кислорода – проявляет переменную валентность 2, 4, 6; хлор – аналог фтора – проявляет валентность 1, 3, 5, 7. Это объясняется наличием свободных d-орбиталей на третьем энергетическом уровне:
Сера 1s22s22p63s23pх23py13pz1 валентность равна 2
Сера 1s22s22p63s23pх13py13pz13d1 валентность равна 4
Сера 1s22s22p63s13pх13py13pz13dх13dy1 валентность равна 6
Ковалентная связь характеризуется направленностью. Связь образуется в направлении максимального перекрытия орбиталей. Направленность связей в молекуле определяет ее пространственную конфигурацию: линейную, тригональную, тетраэдрическую и т. д.
Так в молекуле воды атом кислорода имеет два неспаренных электрона на 2p-орбиталях:
О 1s22s22pх22py12pz1
В трехмерном пространстве эти облака располагаются взаимно перпендикулярно.
Перекрывание этих облаков с 1s-орбиталями атомов водорода происходит наиболее полно лишь в том случае, если атомы водорода присоединяются в направлениях, указанных на  рисунке:
рисунке:
Угол, образованный связями О–Н, согласно этой идеализированной схеме (см. левую конфигурацию), должен составлять 90о. В реальной же молекуле (см. правую конфигурацию) этот угол несколько искажен (105о), что объясняется взаимным отталкиванием ядер водорода. Это отталкивание уменьшается с увеличением радиусов атомов. Так в ряду элементов 6 группы радиусы уменьшаются в последовательности: RTe > RSe > RS > RO; в то же время отклонения валентных углов (от прямых) в соединениях этих атомов с водородом изменяются в обратной последовательности: H2S (92o), H2Se (91o), H2Te (90o).
В атоме азота оси трех р–орбиталей, занимаемые неспаренными валентными электронами, располагаются взаимно перпендикулярно. Однако при образовании трех связей N–H, вследствие взаимного влияния ядер водорода, валентные углы в пирамидальной молекуле NH3 составляют не 90о, а 107о, так как это отображено ниже (конфигурация справа).

Искажения валентных углов в пирамидальных молекулах, также как это констатировалось ранее, уменьшаются с увеличением радиусов атомов от азота к сурьме (Н3Р – 94о, Н3Аs – 92o, H3Sb – 91о).
Гибридизация
В тех случаях, когда в образовании связей участвуют электроны одного и того же атома, находящиеся в различных энергетических (например, s и p) состояниях, процесс формирования связи сопровождается гибридизацией (смешением) электронных орбиталей. Процесс гибридизации сопровождается трансформацией форм, изменением значений энергий орбиталей (электронных облаков), в новые энергетически выгодные (минимальные по значению) и структурно-приемлемые состояния.

Так представленная на рисунке гибридная sp-орбиталь (облако) характеризуется ассиметричным расположением (больше вытянута в одном из направлений от ядра). Это позволяет обеспечить максимальное концентрирование электронной плотности в области перекрывания и как следствие, большую прочность при связывании атомов, чем это же могло иметь место в случае образования связи негибридизованными s- или p-орбиталями.
Общее число гибридных орбиталей определяется и равно количеству, участвующих в образования связи исходных орбиталей:
Таблица 3
Гибридизация орбиталей и пространственная
конфигурация молекул
| Тип молекулы | Исходные орбитали атома А | Тип гибри- диза-ции | Количество гибридных орбиталей атома А | Пространствен-ная конфигура- ция молекулы | Угол между связями, град. |
| АВ2 АВ3 AB4 | S+P S+P+P S+P+P+P | sp sp2 sp3 | Линейная Тригональная Тетраэдрическая | 1800 1200 109.30 |
Рассмотрим возможные типы гибридизации на примерах образования ковалентных связей в молекулах BeCl2, BeCl3, BeCl4.
Молекула BeCl2. Электронные структуры атома хлора, невозбужденного и возбужденного (со звездочкой) атомов бериллия:
· s22s2 Ве; 1s22s12p1 Be*
· 1s22s22p63s23pх23py23pz1 Сl
Возбужденный атом бериллия имеет два неспаренных электрона (2s1 и 2р1), участвующих в образовании химических связей. Различные по форме эти два электронных облака (орбитали) подвергаются гибридизации s + p (sp-гибридизация) в результате чего возникают две гибридные орбитали, расположенные относительно друг друга под углом 180о.

Схема sp-гибридизации
При взаимодействии атома бериллия с двумя атомами хлора происходит перекрывание sp-орбиталей бериллия с
р-орбиталями хлора, что приводит к образованию молекулы линейной формы: Cl-Be-Cl.
Молекула BF3. Электронные структуры атомов фтора, возбужденного и невозбужденного атомов бора:
· 1s22s22p1 В; 1s22s12pх12py1 B*
· 1s22s22pх22py22pz1 F
Атом бора в основном состоянии имеет лишь один неспаренный электрон, а в возбужденном состоянии – три неспаренных электрона.
Неспаренные электроны атома бора находятся на различных (s- и р-) орбиталях. Из одной s- и двух р-орбиталей атома бора образуются три sp2-гибридные орбитали, имеющие одинаковую энергию, форму и располагающиеся в пространстве друг к другу под углом в 120о.
Три неспаренных электрона на гибридных орбиталях бора взаимодействуют с неспаренными электронами атомов фтора с образованием трех ковалентных связей В-F.
Эти три связи располагаются под углом 120о, равно как и гибридные орбитали, и молекула будет иметь форму плоского треугольника.
Молекула СН4. Электронные структуры возбужденного и невозбужденного атомов углерода:
1s22s22p2 С; 1s22s12pх12py1 2pz1 С*
Атом углерода имеет в возбужденном состоянии четыре неспаренных электрона, что соответствует валентности углерода равной 4.
Образование четырех ковалентных связей в молекуле СН4 сопровождается перестройкой электронных орбиталей атома углерода. Вместо одной s- и трех р-орбиталей формируются четыре одинаковые гибридные орбитали, т. е. имеет место sр3-гибридизация. Оси гибридных орбиталей ориентированы в пространстве к четырем вершинам тетраэдра под углом 109о28`.
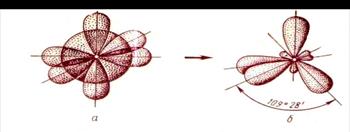
При перекрывании этих орбиталей с 1s-орбиталями четырех атомов углерода получается молекула метана.

Химические связи между атомами в молекулах BeCl2, BF3, CH4 относятся к σ-типу: атомные орбитали перекрываются по линии, соединяющей ядра атомов.
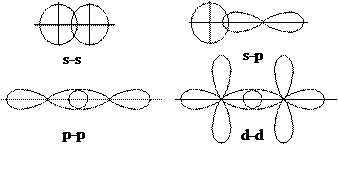
Схема образования σ-связи
Если атомы связаны только σ-связью, то между ними возникает ординарная (или простая) связь. В тех случаях, когда два атома образуют несколько связей, то наряду с σ-связью могут возникать, путем перекрывания р- или d-орбиталей по обе стороны от линии, соединяющей ядра атомов – π-связь
 |
Схема образования π-связи
σ-связи более прочные, чем π-связи, что связано с различиями в степени перекрывания атомных орбиталей.
При получении молекулярного азота из двух атомов в образовании связи принимают участие неспаренные электроны, расположенные на 2р-орбиталях, согласно его электронной структуре:
1s22s22pх12py12pz1
В пространстве р-орбитали каждого атома соориентированы взаимно перпендикулярно. При сближении двух атомов азота одна пара р-орбиталей способна образовать σ-связь, а две другие пары образуют π-связи:

Не нашли, что искали? Воспользуйтесь поиском: