
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Лабораторная работа № 7. Приготовление буферного раствора
Цель работы: научиться выбирать состав буферного раствора с заданным значением рН, рассчитывать количества компонентов, необходимые для приготовления буферного раствора. Познакомиться с понятием емкости буферного раствора и научиться ее определять. Освоить современные методы измерения водородного показателя растворов с помощью рН-метров.
Общие сведения
Буферными называют растворы, способные поддерживать постоянное значение концентрации ионов водорода или гидроксила при разбавлении, а также при добавлении некоторых количеств сильной кислоты или щелочи. Способность раствора поддерживать определенную кислотность среды называют буферным действием. Буферное действие основано на связывании добавляемых ионов Н+ или ОН- в молекулы малодиссоциированных соединений. Основные типы буферных растворов следующие:
Смесь слабой кислоты и ее соли, например, ацетатный буфер: CH3COOH + CH3COONa. Механизм буферного действия следующий:
а) при добавлении кислоты ионы Н+ связываются анионами соли в молекулы слабой кислоты по реакции:
 ;
;
б) при добавлении щелочи ионы гидроксила нейтрализуются слабой кислотой по реакции:
 .
.
Смесь слабого основания и его соли, например, аммиачный буфер: NH4OH + NH4Cl. Буферное действие обусловлено протеканием следующих процессов:
а) при добавлении кислоты ионы Н+ нейтрализуются слабым основанием по реакции:
 ;
;
б) при добавлении щелочи ионы гидроксила связываются катионами соли в молекулы слабого основания:
 .
.
Расчет рН кислого буфера проводят на основании константы диссоциации слабой кислоты:
 ,
,
где p Kd – показатель константы диссоциации слабой кислоты, p Kd = –lg Kd; С с и С к – концентрации соли и килоты соответственно, моль/л
Для основного буфера можно вывести аналогичную формулу, но для расчета гидроксильного показателя:
 ,
,
где p Kd – показатель константы диссоциации слабого основания; С с и С осн – концентрации соли и основания соответственно, моль/л
Водородный показатель основного буфера вычисляют по формуле:
рН = 14 − рОН.
Интегральной емкостью буферного раствора называют число молей сильной кислоты или щелочи, которое требуется прибавить к 1 л буферного раствора для изменения его рН на единицу. После этого раствор практически утрачивает буферное действие. Дальнейшее добавление сильной кислоты или щелочи вызывает резкое изменение рН раствора. Поэтому емкость буферного раствора можно определить экспериментально путем титрования сильной кислотой или, соответственно, щелочью с цветными индикаторами. Рассчитывают емкость буферных растворов на основе формул вычисления рН. Емкость кислого буфера по щелочи, В Щ рассчитывают исходя из уравнения:
 ,
,
при решении которого получается формула:
 .
.
Емкость кислого буфера по кислоте вычисляют на основе уравнения:
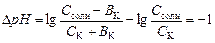 ,
,
из которого выводят расчетную формулу:
 .
.
Емкости основного буфера по кислоте и по щелочи определяются согласно уравнениям:
 и
и  .
.
Выбор состава буферного раствора. Отношение С с/ С к или С с/ С осн выбирают в пределах 0,1< С соли/ С к-ты <10. По таблицам констант диссоциации подбирают слабую кислоту с p Kd = pH±1(или слабое основание с p Kd = pOH ±1), исходя из заданного значения рНвычисляют отношение концентраций С с / С к (или С с / С осн).
Выполнение работы
Не нашли, что искали? Воспользуйтесь поиском: