
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Определите, является данный комплекс диамагнетиком или парамагнетиком.
Механизм образования связей в комплексном ионе – донорно-акцепторный.
донорно-акцепторный механизм образования связи (по методу ВС)
А + В → АВ
Роль донора (поставщика пары электронов) играет лиганд, акцептором (принимает электроны на вакантные орбитали) является комплексообразователь.
В комплексном ионе [Ni(NO2)4]2 – : акцептор – ион Ni2+ , доноры – ионы NO2-.
Электронная формула комплексообразователя: Ni2+ … 3 d 84 s 0.
Лиганды – NO2- - лиганды сильного поля, следовательно, под их воздействием электроны на 3 d -подуровне в ионе Ni2+ максимально спариваются. Распределение электронов комплексообразователя и лигандов по орбиталям:
:NO2 :NO2 :NO2 :NO2
Ni2+ 3d 4s 4p

Неподеленные пары электронов 4-х лигандов NO2- заполняют
четыре гибридизованные свободные орбитали (одну 3 d -, одну 4 s -, две 4 p -) иона комплексообразователя Ni2+ . При образовании связей происходит dsp 2 - гибридизация, пространственная структура комплексного иона [Ni(NO2)4]2 - – плоский квадрат.
В комплексном ионе [Ni(NO2)4]2 - нет неспаренных электронов, следовательно, данный комплекс является диамагнетиком.
ДОПОЛНИТЕЛЬНО:
Гибридизация. Форма гибридной орбитали:

 Схема sр -гибридизации
Схема sр -гибридизации  Схема sр2-гибридизации
Схема sр2-гибридизации
 Схема sр3-гибридизации
Схема sр3-гибридизации
| Орбитали, участвующие в гибридизации | Тип гибридизации | Структура молекулы | Валентный угол |
| S + p | sp |  Линейная
Линейная
| 180о |
| S + p + p | sp2 |  плоский треугольник
плоский треугольник
| 120о |
| S + p + p + p | sp3 |  тетраэдр
тетраэдр
| 109,3о |
Рассмотрим примеры:
Молекула ВН3
В… 2s22p1 Þ В* …2s12p2 H …1s1
H 1s1 H 1s1 H 1s1

sp2–гибридизация АО бора В; 3 s - связи, Ð 120°,
ЭОB =2,0, ЭОH = 2,1 Þ DЭО ¹0 Þ Связь полярная, mсв ¹ 0
структура молекулы - плоский треугольник.
m мол = S m св = 0 Þ молекула ВН3 - неполярная.
Молекула SnCl4
Sn …5s25p2 Þ Sn* …5s15p3 Cl … 3s23p5
Sn* …5s15p 3
Cl 3s23p5 Cl 3s23p5 Cl 3s23p5
sp3–гибридизация АО Sn (s -АО и 3 р- АО)
структура молекулы Þ тетраэдр, 4 s - связи, Ð 109,30
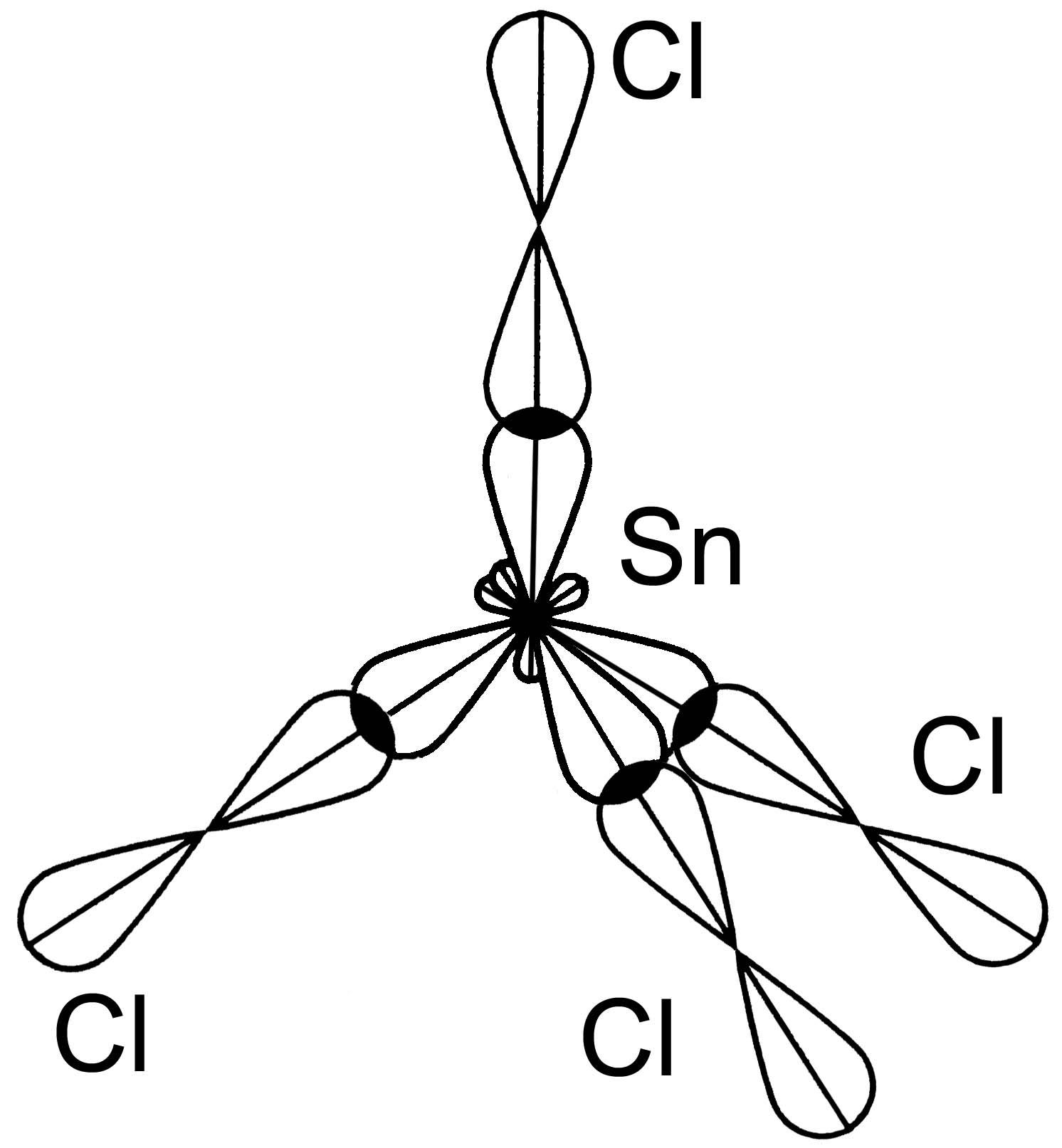
ЭОCl =3,0, ЭОSn = 1,8 Þ DЭО ¹0 Þ Связь полярная, mсв ¹ 0.
m мол = S m св = 0 Þ молекула SnCl4 - неполярная.
ДОПОЛНИТЕЛЬНО:
Комплексное соединение: [A+(m-n)(B)n]±mDm
K[Ag(CN)2] Fe(H2O)6]Cl 2 [Cu(NH3)4]SO4
комплексный ион: [A+(m-n)(B)n]±m
анионы – [Ag(CN)2]-, катионы – [Cu(NH3)4]2+, [Fe(H2O)6]2+
ВНУТРЕННЯЯ СФЕРА (комплекс)
комплексообразователь лиганды
центральный ион A+(m-n) молекулы B или ионы B-
ПРИМЕР:
комплексные ионы: [Ag(CN)2]- [Cu(NH3)4]2+
комплексообразователи: Аg+ Cu2+
лиганды: CN - NН3
координационные числа: 2 4
Если комплексообразователь – d 1-9-элемент:
орбитали лигандов, взаимодействуя с орбиталями комплексообразователя, оказывают влияние на состояние его электронов на d - орбиталях. Þ Неспаренные электроны, испытывая отталкивание от электронных пар лигандов, могут спариваться, переходя на более дальние от лигандов d- орбитали центрального атома.
Электроны на d -подуровне комплексообразователя максимально спариваются под действием лигандов сильного поля.
При действии лигандов слабого поля расположение электронов на d - подуровне не меняется.
Для 3 d -элементов - спектрохимический ряд лигандов
в порядке возрастания силы поля:
слабое поле среднее поле сильное поле
I-< Br -< Cl- < ОН- < F- < H2O < NCS- < NH3 < NO2- < CN- < CO
Для 4 d-, 5 d - элементов – все лиганды являются сильными.
Возможные типы гибридизации при образовании комплексов
| К.ч. n | комплексо образователь | лиганды | гибридизация орбиталей | структура комплекса |
| любой | любые | sp | линейная | |
| 3 d- элемент | слабого поля | d3s, d2sp, sp3 | тетраэдр | |
| 3 d-, 4 d-, 5 d- элемент | сильного поля | dsp2 | плоский квадрат | |
| 3 d- элемент | слабого поля | sp3d2 | октаэдр | |
| 3 d-, 4 d-, 5 d- элемент | сильного поля | d2sp3, dsp3d | октаэдр |
Примеры:
1. Комплекс [Fe(Н2О)6]2+
Комплексообразователь Fe2+: 3d64s0.
Лиганды Н2О - лиганды среднего поля, а для Fe2+ (низшая степень окисления) они относятся к слабым.
:Н2О:Н2О:Н2О:Н2О:Н2О:Н2О
Fe2+
3d 4s 4p 4d
 sp3d2 -гибридизация орбиталей,
sp3d2 -гибридизация орбиталей,
структура комплекса - октаэдр.
2. Комплекс [Fe(CN)6]4-
Комплексообразователь Fe2+: 3d64s0.
Лиганды CN - - лиганды сильного поля,

|
:CN-:CN-:CN-:CN-:CN-:CN-
Fe2+
3 d 4 s 4 p
d2sp3-гибридизация орбиталей, структура комплекса - октаэдр.
Наличие в комплексном соединении неспаренных электронов определяет магнитные свойства вещества.
Если в комплексном ионе нет неспаренных электронов - данный комплекс является диамагнетиком. ( Комплекс [Fe(CN)6]4-).
Если в комплексном ионе есть неспаренные электроны - данный комплекс является парамагнетиком. ( Комплекс [Fe(Н2О)6]2+).
ПРИЛОЖЕНИЕ. Табл. электроотрицательность элементов
| H 2,1 | ||||||||||||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | ||||||||||
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | ||||||||||
| K 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,5 | V 1,6 | Cr 1,6 | Mn 1,5 | Fe 1,8 | Co 1,9 | Ni 1,9 | Cu 1,9 | Zn 1,6 | Ga 1,6 | Ge 1,8 | As 2,0 | Se 2,4 | Br 2,8 |
| Rb 0,8 | Sr 1,0 | Y 1,2 | Zr 1,4 | Nb 1,6 | Mo 1,8 | Tc 1,9 | Ru 2,2 | Rh 2,2 | Pd 2,2 | Ag 1,9 | Cd 1,7 | In 1,7 | Sn 1,8 | Sb 1,9 | Te 2,1 | I 2,5 |
| Cs 0,7 | Ba 0,9 | La-Lu 1,0-1,2 | Hf 1,3 | Ta 1,5 | W 1,7 | Re 1,9 | Os 2,2 | Ir 2,2 | Pt 2,2 | Au 2,4 | Hg 1,9 | Tl 1,8 | Pb 1,9 | Bi 1,9 | Po 2,0 | At 2,2 |
Не нашли, что искали? Воспользуйтесь поиском: