
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Контрольные вопрросы
- Комплексные соединения. Строение комплексных соединений согласно теории А. Вернера (комплексообразователи, лиганды, координационные числа, внутренняя и внешняя сфера).
- Классификация комплексных соединений по различным признакам.
- Заряд комплексного иона. Катионные, анионные, нейтральные комплексные соединения, их номенклатура. Примеры.
- Устойчивость комплексных соединений. Константа нестойкости, уравнение изотермы.
- Моно- и полидентатные лиганды. Хелаты. Комплексоны. Трилон Б. Краун–эфиры.
- Значение комплексных соединений в биологии и медицине.
Типовые задачи
Задача 1. Определите заряд комплексного иона [ Cr+3Cl3(H2O)]x.
x = 1 · (+3) + 3 · (-1) + 1 · (0) = -2
Ответ: x = -2.
Задача 2. Назовите комплексное соединение Ca[ Pt+4(NO2)4(Cl)2].
Ответ:дихлоротетранитроплатинат (IV) кальция
Задача 3. Напишите формулу комплексного иона акватригидроксокупрат (II).
Ответ: [Cu+2(OH)3(H2O)]–
Задача 4. На осаждение ионов брома из раствора комплексной соли [Cr+3 (NH3)6 ] Br3 израсходовано 0,5 дм3 раствора AgNO3 с молярной концентрацией вещества в растворе С(AgNO3) = 0,2 моль/дм3. Сколько граммов комплексной соли содержалось в растворе?
Дано: Решение:
 |
 Vр-ра = 0,5 дм3 По закону эквивалентов:
Vр-ра = 0,5 дм3 По закону эквивалентов:
 С(AgNO3) = 0,2 моль/дм3 n(AgNO3) = n(⅓[Cr+3(NH3)6] Br3)
С(AgNO3) = 0,2 моль/дм3 n(AgNO3) = n(⅓[Cr+3(NH3)6] Br3)
m([Cr+3(NH3)6] Br3) -? M(AgNO3) = 170 г/моль
М(⅓[Cr+3(NH3)6]Br3) = 397 / 3 = 132,3 г/моль
m(AgNO3) = C(AgNO3) · M(AgNO3) · Vр-ра
 |
m(AgNO3) = 0,2 · 170 · 0,5 = 17 г
Ответ:m([Cr+3(NH3)6]Br3) = 13,23 г.
Задача 5. Вычислить DG0 процесса:
[Co(SCN)4]2- «Co2+ + 4 SCN-,
если Кнест = 5,5 · 10-3 при 250С.
Дано: Решение:
 Кнест = 5,5 · 10-3 По уравнению изотермы:
Кнест = 5,5 · 10-3 По уравнению изотермы:
Т = 298 К DG0 = - R · T · ln Kнест
R = 8,314 Дж·моль-1·К-1 DG0 = -8,314 · 298 · ln 5,5·10-3 = 12890,8 Дж/моль »
 » 12,89 кДж/моль
» 12,89 кДж/моль
DG0 -?
Ответ: DG0 = 12,89 кДж/моль.
Тестовые задания
Выберите правильный вариант ответа
01. ОПРЕДЕЛИТЕ ЗАРЯД И НАЗОВИТЕ КОМПЛЕКСНОЕ СОЕДИНЕНИЕ
[Ni2+(CI)3 (NH3)3]x
1) –1; триамминотрихлороникелат (II)
2) –1; триамминтрихлороникелат (II)
3) +1; триамминтрихлороникелат (II)
4) +1; триамминотрихлорникелат (II)
02. ОПРЕДЕЛИТЬ ЗАРЯД КОМПЛЕКСА – АММИНДИНИТРОТРИХЛОРОХРОМАТ(III)
1) –2
2) –3
3) –1
4) +2
03. КАК НАЗЫВАЕТСЯ ПРОЦЕСС
[Cu(NH3)4]SO4 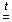 CuSO4 + 4NH3
CuSO4 + 4NH3 
1) первичная диссоциация комплекса
2) вторичная диссоциация комплекса
3) разложение комплекса
4) образование комплекса
04. КАК НАЗЫВАЕТСЯ ПРОЦЕСС
K2[PtCl4] = 2K+ + [PtCl4]2–
1) первичная диссоциация комплекса
2) вторичная диссоциация комплекса
3) разложение комплекса
4) образование комплекса
05. ОПРЕДЕЛИТЕ ЗАРЯД И НАЗОВИТЕ КОМПЛЕКСНОЕ СОЕДИНЕНИЕ
[Тi4+(NO2)3(Cl)2(H2O)]х
1) –1; аквадихлоротринитратотитанат (IV)
2) +1; аквадихлоротринитротитан(IV)
3) –1; аквадихлоротринитротитанат (IV)
4) +1; аквадихлоротринитратотитан (IV)
06. ВЫЧИСЛИТЕ ∆G0 ПРОЦЕССА [Сu (NО2)4]2 – ↔ Cu2+ + 4NО2–, ЕСЛИ ДЛЯ ДАННОГО КОМПЛЕКСА ПРИ 250С, К нест. = 2,5·10– 5
1) –13,9 кДж·моль–1
2) 26,25 кДж·моль–1
3) 13,9 кДж·моль–1
4) – 26,25 кДж·моль–1
Не нашли, что искали? Воспользуйтесь поиском: