
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Гены и нарушения метаболизма
Люди — плохой «материал» для изучения законов наследственности, потому что у них трудно получить достаточно надежные данные, но первые наблюдения, как гены осуществляют свою функцию, были сделаны именно на людях. В самом начале XX века английский врач Арчибальд Гаррод1 заинтересовался наследственностью лиц с определенными нарушениями и начал сравнивать их биохимические анализы с анализами нормальных людей. Одно из таких нарушений, передающееся по аутосомному рецессивному образцу, — алкаптону-рия, выражающаяся, в частности, в том, что моча таких людей на воздухе темнеет (становится темно-красной или черной). Обычно это замечают уже родители, когда видят, что пеленки их ребенка становятся темными. Люди с этим нарушением выделяют большое количество гомогентизиновой кислоты (алкаптона), которая и темнеет при реакции с кислородом. У нормальных людей клетки преобразуют эту гомогентизиновую кислоту в малеилук-сусную кислоту. Отсюда следует, что алкаптонурия происходит от отсутствия ферментов, которые обычно ускоряют эту реакцию. Вспомним, что все вещества в организме образуются или разрушаются в процессе метаболических реакций, или метаболических путей, которые представляют собой серию химических реакций при участии катализирующих ферментов. Гаррод назвал алкаптонурию и схожие с ней симптомы врожденными нарушениями метаболизма.
Характер этих нарушений предполагает, что гены передают информацию о производстве ферментов. У обычных людей имеется аллель Аl, который вырабатывает фермент, преобразующий гомогентизиновую кислоту в малеилуксусную кислоту. Страдающие алкаптонурией гомозиготны по рецессивному аллелю al, содержащему «испорченную» информацию. У гетерозигот также содержится один нормальный аллель, поэтому у них не проявляется признаков нарушения метаболизма. Гаррод заметил также, что альбинизм проявляется похожим образом: в коже, волосах и радужной оболочке глаз отсутствует обычный пигмент меланин. Меланин образуется с помощью ферментов из тирозина в ходе нескольких реакций, у альбиносов не вырабатывается фермент для одной из них. Такая связь между генами и составляющими веществами организма весьма знаменательна.
Нам известно несколько наследственных нарушений, блокирующих метаболические пути, ведущие к образованию меланина и малеилуксусной кислоты (рис. 6.1). На основании подобных наблюдений можно сделать вывод, что гены ответственны за выработку ферментов и как следствие контролируют метаболизм в целом. Некоторые нарушения метаболизма даже определили ход истории. Например, известно такое нарушение метаболизма, как порфириновая болезнь, при которой не расщепляются порфирины. Их избыток приводит к психическим расстройствам.

Рис. 6.1. Метаболические пути тирозина и фенилаланина в организме человека. Отсутствие ферментов на определенных этапах приводит к специфическим наследственным нарушениям метаболизма
Несдержанное поведение английского короля Георга III — один из факторов, ускоривших революцию в Америке — было результатом порфириновой болезни, унаследованной им от шотландской королевы Марии.
Гены и ферменты
В 1944 году Джордж Бидл и Эдвард Тэйтем подтвердили правильность выводов Гаррода на примере хлебной плесени Neurospora (эта плесень ярко-оранжевого цвета иногда образуется на черством хлебе). Хлебную плесень можно выращивать на простой питательной среде — в смеси сахара, витамина биотина и нескольких солей, растворенных в воде. Из этих веществ плесень синтезирует все необходимые сложные компоненты. Такие организмы, не требующие для своей жизнедеятельности сложных веществ, называются прототрофами. Бидл и Тэйтем подвергали плесень облучению с целью ускорения процесса мутаций и затем искали среди различных популяций ауксотрофы, то есть организмы, утратившие способность синтезировать одно из веществ, необходимых для их роста, и, таким образом, способных жить только в питательной среде с этим веществом.
Особое внимание Бидл и Тэйтем обратили на мутантную плесень, которая для своего существования требовала аминокислоту аргинин. Аргинин — необходимая составляющая всех белков, и обычная плесень Neurospora синтезирует ее из сахара и других веществ раствора. Однако нарушения метаболического процесса у мутантной плесени не позволяют вырабатывать аргинин, поэтому без добавления этой аминокислоты она расти не может. По своей структуре аргинин похож на две другие аминокислоты — орнитин и цитруллин, поэтому Билл и Тэй-тем предположили, что некоторые мутанты могут расти в среде с этими веществами вместо аргинина. Таким образом, они разделили ауксотрофы по аргинину на несколько классов. Мутанты класса I могли расти только в среде с аргинином; мутанты класса II — в среде с аргинином или цитруллином; мутанты класса III — в среде с аргинином, цитруллином или орнитином. На основании этих результатов Бидл и Тэйтем сделали вывод, что: 1) отдельный ген передает информацию о синтезе отдельного фермента; 2) каждый мутант, дефективный по одному гену, не может вырабатывать один фермент; 3) биосинтетический путь, ведущий к образованию аргинина, имеет следующий вид:
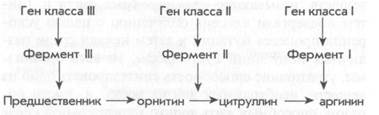
Каждую реакцию контролирует особый фермент, и у каждого мутанта соответствующим образом блокируется производство этого фермента. Мутанты не могут расти в среде, в которой присутствуют вещества, производимые до блокировки: например, мутанты класса II не могут расти в среде с орнитином. Если в среде присутствуют вещества, производимые после блокировки, то организм получает все необходимые вещества для производства аргинина и может расти. Так, мутанты класса III не могут преобразовывать вещества-предшественники в ор-нитин, но если в их питательную среду добавить орнитин, они перерабатывают орнитин в цитрул-лин, а цитруллин — в аргинин. Позднее биохимические эксперименты доказали, что эти реакции происходят именно в таком порядке.
На основании полученных результатов Билл и Тэйтем высказали гипотезу «один ген — один фермент», согласно которой каждый ген контролирует производство отдельного фермента. Фактически они вплотную подошли к представлению о том, что гены переносят информацию о производстве белков, так как ферменты являются очень важным типом белков (но, как мы сказали в гл. 3, существуют и другие белки). Согласно более современной версии принципа Бидла и Тэйтема каждый ген кодирует производство отдельной полипептидной цепи (напомним, что полипептид — это цепь аминокислот). Некоторые белки состоят из одного полипептида, другие — из двух и более.
Белки и информация
Поскольку гены контролируют производство и синтез белков, то еще раз рассмотрим структуру белков. Как было сказано в гл. 3, белки — наиболее разнообразные молекулы организма. Они являются составной частью всех мембран; образуют большую часть рибосом («фабрик» по производству белков); входят в состав многих структурных частей клетки определяющих ее форму и строение; белки — активные компоненты мышечных волокон, позволяющих нам выполнять движения. Из белков состоят такие образования, как волосы, кожа, сухожилия и (в сочетании с кристаллами фосфата кальция и магния) кости. Белками являются некоторые гормоны, такие как инсулин, которые переносят химические послания от одного типа клеток к другим. И что самое важное, белки выполняют также функцию ферментов.
Вспомним, что белки представляют собой длинные цепи полимеров, состоящих из 20 видов аминокислот, соединенных друг с другом полипептидной связью. Связь образуется в ходе химических реакций, идущих с выделением воды в качестве побочного продукта. Полипептид может состоять из очень большого количества аминокислот. В наше время с помощью особых приборов можно быстро определить состав аминокислот в белке. Анализ белков показал, что каждый из них характеризуется уникальной последовательностью аминокислот, называемой первичной структурой. Все молекулы белков одного вида имеют одинаковую последовательность. Например, если обозначить аминокислоты по трем буквам их названия (латинского), то полипептид Glu—Gly— Pro—Trp—Leu—Glu—Ala— —Tyr—Gly—Trp—Met—Asp—Phe — это гормон гаст-рин, способствующий пищеварению, а полипептид Туг—Gly—Gly—Phe—Met — энкефалин, обладающий опиатным действием в нервной системе. Эти последовательности всегда записываются начиная с амин-ного конца, то есть со свободной аминогруппы, и заканчиваются карбоксильным концом, то есть свободной карбоксильной группой. Однако большийство других белков — очень большие молекулы, состоящие из нескольких сотен аминокислот; замена всего лишь одной кислоты может иногда привести к образованию совсем другого белка с другой структурой; чаще всего такая замена приводит к утрате функций белка.
Первичная структура, как правило, определяет свойства любого белка, включая то, как эти длинные цепи принимают особую форму в пространстве (рис. 6.2). Сила притяжения между атомами в каждой молекуле белка заставляет полипептидную цепь принимать специфическое положение, и так получается структура, способная выполнять ту или иную функцию — например, небольшой «карман» или активный центр, с помощью которого фермент катализирует химическую реакцию.

Рис. 6.2. Трехмерная структура белка миоглобина. Показаны не все атомы; жирной линией обозначен «каркас» пептидной цепи, который образуют несколько спиральных сегментов, соединенных цепями с менее регулярной формой
Многие функциональные белки, кроме того, состоят из двух полипептидов и более.
Когда говорят о генах, часто используют термин информация, особенно генетическая информация. Вспомним (гл. 3), что информация позволяет сделать выбор из нескольких возможных вариантов, что особенно важно для структуры белка. Так, упомянутая последовательность гастрина — это одна из 2013 возможных последовательностей из 20 видов аминокислот по 13 в ряд. Понятно, что для постройки этого белка требуется много информации, хотя не так много, как для более типичных белков, состоящих из 300 аминокислот. Где-то в геноме человека должен присутствовать ген, определяющий последовательность гастрина: он переносит информацию о том, какие аминокислоты должны следовать друг за другом. Структурную перестройку в этом гене, приводящую к замене информации, называют мутацией. (Позже мы узнаем, что некоторые мутации затрагивают синтез белка или контроль над ним.)
Нарушение связи между геном и белком иллюстрирует такое наследственное заболевание, как сер-повидноклеточная анемия. Почти половина объема крови у нормального человека состоит из округлых, дискообразных красных кровяных клеток — эритроцитов, которые содержат гемоглобин, придающих им цвет. Гемоглобин переносит кислород, необходимый для нормального метаболизма клеток; красные кровяные тельца проникают по тонким капиллярам в самые удаленные уголки тканей и доставляют им кислород. Преобладает тип гемоглобина А (Нb А), который состоит из четырех полипептидных цепей: двух цепей альфа (по 141 аминокислоте в каждой) и двух цепей бета (по 146 аминокислот) (рис. 6.3). Это так называемые глобиновые части молекулы; каждая из них переносит небелковую группу гем — большую кольцевидную молекулу с атомом железа посередине. Именно благодаря атому железа эта часть присоединяет кислород. Отсюда понятна необходимость железа в составе нашей пищи.
Серповидноклеточная анемия характеризуется ненормальным строением гемоглобина, Hb S, который кодируется мутантным аллелем HbS. Kpacные кровяные тельца с ненормальным гемоглобином имеют необычную форму, и некоторые из них похожи на серп (рис. 6.4).
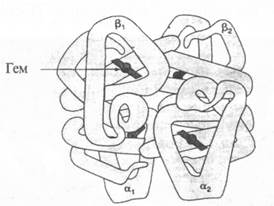
Рис. 6.3. Трехмерная структура гемоглобина. Каждая молекула состоит из четырех полипептидных цепей — двух альфа-цепей и двух бета-цепей. Эти цепи, комплементарные друг другу, образуют четвертичную структуру белка. В каждой цепи имеется по большому гему с атомом железа в центре; именно к нему присоединяется кислород
Такие кровяные клетки с трудом передвигаются по сосудам и иногда закупоривают их, вызывая сильную боль, повреждения органов и тканей, а в некоторых случаях даже служат причиной смерти. Анемия возникает в результате того, что серповидные клетки разрушаются обычно в три раза быстрее нормальных. У гетерози-гот HbAHbS проявляются некоторые черты этого заболевания, но клеток с гемоглобином НbА у них достаточно для нормального функционирования, поэтому они, как правило, здоровы. Анемия возникает только в 1 % случаев. Серповидноклеточная анемия широко распространена в Африке и других регионах, где распространена малярия. Поскольку лица, в крови которых присутствует гемоглобин Hb S, более устойчивы к малярии, то у гетерозигот имеется некоторое преимущество, и эти черты закрепились в некоторых популяциях (в других странах серповидноклеточная анемия чаще наблюдается также среди выходцев из Африки).

Рис. 6.4. Электронная микрофотография красных кровяных клеток человека, больного серповидноклеточной анемией. Ясно видна необычная форма этих клеток, отличающихся от нормальных — округлых. Публикуется с разрешения фотобиблиотеки Omikron/'Science
В J956 году Верной Инграм доказал, что гемо-глобины НbА и HbS различаются только по одной аминокислоте в бета-цепи (шестая от аминного конца). Обычно это глутаминовая кислота, но в HbS она заменена на валин:
Hb A: Val-His-Leu-Thr-Pro-G/u-Glu-Lys;
Hb S: Val-His-Leu-Thr-Pro-Va/-Glu-Lys.
Таким образом, во всей последовательности 146 аминокислот замена всего лишь одной из них приводит к опасному заболеванию.
В дальнейшем была определена последовательность обеих полипептидных цепей гемоглобина и обнаружены другие возможные нарушения (рис. 6.5). В каждом случае дефектный аллель приводит к образованию гемоглобина, идентичного нормальному за исключением одной аминокислоты или (иногда) короткой последовательности аминокислот. Соответствие «одна мутация — одна аминокислота» подтверждает мысль о том, что каждый отдельный ген определяет последовательность отдельного белка и что ген состоит из единиц, кодирующих отдельные аминокислоты, причем мутации может подвергаться каждая единица. Обычно мутация затрагивает одну аминокислоту, и образующийся белок лишь слегка отличается от нормального по форме и функциям.

Рис. 6.5. Последовательность первых 28 аминокислот нормальной бета-цепи гемоглобина человека с указанием возможных замен аминокислот в результате мутации. Одни мутации обозначаются буквами, другие — названиями мест, где были обнаружены страдающие этими наследственными нарушениями. Одна из мутаций представляет собой отсутствие аминокислоты
Другие мутации стирают одну или несколько аминокислот, а некоторые изменяют по следовательность аминокислот или добавляют новый фрагмент к обычному белку.
Не нашли, что искали? Воспользуйтесь поиском: