
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ТЕМА 8. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
Вариант № 1
Дополните:
1. Электролиты – это ________________________________________________
2. К сильным электролитам относятся: _________________________________
3. Кислоты – это ____________________________________________________
4. Общие свойства оснований обусловлены наличием ___________________, окрашивают индикаторы ___________________, взаимодействуют: ________
5. Кислые, основные и комплексные соли диссоциируют _________________
Выберите правильный вариант ответа:
6. Диссоциация по трём ступеням возможна в растворе:
1) гидроксида алюминия 3) нитрата алюминия
2) хлорида алюминия 4) ортофосфата калия
7. Наиболее слабым электролитом является:
1) HF 2) HCl 3) HBr 4) HI
8. В качестве катионов только ионы  образуются при диссоциации
образуются при диссоциации
1) NaOH 2) NaH2PO4 3) H2SO4 4) NaHSO4
9. Уравнение реакции практически осуществимой в водном растворе имеет вид
1) CuSO4 + 2KOH → K2SO4 + Cu(OH)2
2) Fe2(SO4)3 + 6HNO3 → 2Fe(NO3)3 + 3H2SO4
3) NaNO3 + HCl → NaCl + HNO3
4) Ba(NO3)2 + 2NaOH → 2NaNO3 + Ba(OH)2
10. Уравнению реакции Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O соответствует сокращенное ионное уравнение
1) 
2) 
3) 
4) 
11. Сокращенное ионное уравнение  соответствует взаимодействию веществ
соответствует взаимодействию веществ
1) Fe(NO3)3 и KOH 3) Na2S и Fe(NO3)2
2) FeSO4 и LiOH 4) Ba(OH)2 и FeCl3
12. При взаимодействии оксида серы (ΙV) с избытком раствора NaOH образуется ___________________
1) гидросульфат натрия 3) гидросульфит натрия
2) сульфат натрия и вода 4) сульфит натрия и вода
Сумма коэффициентов в кратком ионном уравнении равна _______________
13. При взаимодействии ионов  с гексацианоферратом (ΙΙΙ) калия K3[Fe(CN)6] – красной кровяной солью (к.к.с) наблюдается образование ____
с гексацианоферратом (ΙΙΙ) калия K3[Fe(CN)6] – красной кровяной солью (к.к.с) наблюдается образование ____
1) темно-синего осадка 3) бурого осадка
2) белого осадка 4) кроваво-красного раствора
Вариант № 2
Дополните:
1. Электролитическая диссоциация – это _______________________________
2. В растворе сильных электролитов больше частиц _____, но меньше ______
3. К слабым электролитам относятся: __________________________________
4. По типу сильного электролита в одну ступень диссоциируют: ___________
5. Закон разбавления Оствальда устанавливает зависимость между ______ и имеет следующее математическое выражение ___________________________
Выберите правильный вариант ответа:
6. Диссоциация по трём ступеням возможна в растворе:
1) хлорида алюминия 3) нитрата алюминия
2) ортофосфата калия 4) ортофосфорной кислоты
7. К сильным электролитам относятся (несколько вариантов ответа):
1) PbI2 2) H2CO3 3) NaOH 4) Al2(SO4)3
8. В качестве анионов только ионы  образуются при диссоциации
образуются при диссоциации
1) Cr(OH)2NO3 2) KOH 3) HNO3 4) MgOHCl
9. Уравнение реакции практически осуществимой в водном растворе имеет вид
1) Ba(NO3)2 + K2SO4 → BaSO4 + 2KNO3
2) BaCl2 + 2KOH → Ba(OH)2 + 2KCl
3) ZnCl2 + H2SO4 → ZnSO4 + 2HCl
4) Na2SO4 + 2KOH → K2SO4 + 2NaOH
10. Уравнению реакции CaCO3 + 2HCl → CaCl2 + CO2 + H2O соответствует сокращенное ионное уравнение
1) 
2) 
3) 
4) 
11. Сокращенное ионное уравнение  соответствует взаимодействию веществ:
соответствует взаимодействию веществ:
1) H2CO3 и Na2S 3) H3PO4 и K2S
2) HCl и CuS 4) HBr и (NH4)2S
12. При взаимодействии ортофосфорной кислоты с избытком раствора КOH образуется ___________________
1) ортофосфат калия и вода 3) дигидроортофосфат калия и вода
2) гидроортофосфат калия и вода 4) ортофосфат калия
Сумма коэффициентов в кратком ионном уравнении равна _______________
13. При взаимодействии ионов  с гексацианоферратом (ΙΙ) калия K4[Fe(CN)6] – желтой кровяной солью (ж.к.с) наблюдается образование _____
с гексацианоферратом (ΙΙ) калия K4[Fe(CN)6] – желтой кровяной солью (ж.к.с) наблюдается образование _____
1) бурого осадка 3) белого осадка
2) темно-синего осадка 4) кроваво-красного раствора
Вариант № 3
Дополните:
1. Степень электролитической диссоциации – это ________________________
2. В растворе слабых электролитов больше частиц ________, но меньше ____
3. Основания – это __________________________________________________
4. Общие свойства кислот обусловлены наличием ______________________, окрашивают индикаторы _____________, взаимодействуют: ______________
5. С уменьшением концентрации слабого электролита, степень диссоциации
его ______________, согласно закона _________________________________
Выберите правильный вариант ответа:
6. Диссоциация по четырем ступеням возможна в растворе
1) ортосиликата калия 3) ортокремниевой кислоты
2) дигидроортосиликата натрия 4) гидросиликата калия
7. К сильным электролитам относятся (несколько вариантов ответа):
1) Ca3(PO4)2 2) NH4OH 3) HI 4) CuSO4
8. В качестве катионов только ионы  образуются при диссоциации
образуются при диссоциации
1) KHCO3 2) HNO3 3) Na2HPO4 4) KOH
9. Уравнение реакции практически осуществимой в водном растворе имеет вид
1) Al2(SO4)3+ 6HNO3 → 2Al(NO3)3 + 3H2SO4
2) KNO3 + HBr → KBr + HNO3
3) ZnSO4 + K2S → ZnS + K2SO4
4) Ba(NO3)2 + 2KOH → 2KNO3 + Ba(OH)2
10. Уравнению реакции Fe(OH)2 + H2SO4 → FeSO4 + 2H2O соответствует сокращенное ионное уравнение:
1) 
2) 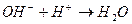
3) 
4) 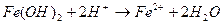
11. Сокращенное ионное уравнение  соответствует взаимодействию веществ
соответствует взаимодействию веществ
1) CaCl2 и Na2CO3 3) CaS и CO2
2) Ca(OH)2 и CO2 4) Ca3(PO4)2 и K2CO3
12. При взаимодействии оксида углерода (ΙV) с избытком раствора КOH образуется _________________________
1) карбонат калия и вода 3) гидрокарбонат калия
2) карбонат калия 4) гидрокарбонат калия и вода
Сумма коэффициентов в кратком ионном уравнении равна _______________
13. При взаимодействии ионов  с сероводородом (H2S) наблюдается образование ______________________________
с сероводородом (H2S) наблюдается образование ______________________________
1) черного осадка 3) бурого осадка
2) белого осадка 4) темно-синего осадка
Вариант № 4
Дополните:
1. Степень электролитической диссоциации зависит от следующих факторов: __
2. Соли – это ____. Средние, двойные и смешанные соли диссоциируют ______
3. Амфотерные основания диссоциируют: 1 – ______________________
2 – ______________________
4. Константа диссоциации (Кд) характеризует _________________, для HNO2 имеет следующее математическое выражение __________________________
5. Слабые многокислотные основания и многоосновные кислоты диссоциируют _____________________________________________________
Выберите правильный вариант ответа:
6. Диссоциация по двум ступеням возможна в растворе
1) угольной кислоты 3) карбоната калия
2) ортофосфата натрия 4) хлорида цинка
7. Наиболее слабым электролитом является
1) HCN 2) Al2(SO4)3 3) Ca(OH)2 4) HCl
8. В качестве анионов только ионы  образуются при диссоциации
образуются при диссоциации
1) Fe(OH)2Cl 2) NaOH 3) H2SO4 4) (MgOH)2SO4
9. Уравнение реакции практически осуществимой в водном растворе имеет вид:
1) MgSO4 + 2KOH → Mg(OH)2 + K2SO4
2) K2SO4 + Mg(NO3)2 → MgSO4 + 2KNO3
3) FeCl2 + H2SO4 → FeSO4 + 2HCl
4) BaCl2 + 2HNO3 → Ba(NO3)2 + 2HCl
10. Уравнению реакции K2CO3 + CaBr2 → CaCO3 + 2KBr соответствует сокращенное ионное уравнение
1) 
2) 
3) 
4) 
11. Сокращенное ионное уравнение  соответствует взаимодействию веществ
соответствует взаимодействию веществ
1) CuCl2 и H2O 3) CuO и H2O
2) CuCl2 и NaOH 4) Cu и NaOH
12. При взаимодействии хлорида железа (ΙΙ) с недостатком раствора NaOH образуется ___________________________
1) гидроксид железа (ΙΙ) и хлорид натрия
2) гидроксохлорид железа (ΙΙ) и хлорид натрия
3) гидроксид железа (ΙΙ)
4) гидроксохлорид железа (ΙΙ)
Сумма коэффициентов в кратком ионном уравнении равна _______________
13. При взаимодействии ионов  с раствором щелочи при нагревании наблюдается образование ____________________________________________
с раствором щелочи при нагревании наблюдается образование ____________________________________________
1) NH3 со специфическим запахом 3) раствор синего цвета
2) черного осадка 4) бурого осадка
Не нашли, что искали? Воспользуйтесь поиском: