
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ТЕМА 9. ГИДРОЛИЗ СОЛЕЙ
Вариант № 1
Дополните:
1. Гидролиз соли – это _______________________________________________
2. Количественная характеристика гидролиза соли – это величина, называемая _________________, обозначается буквой ____________________
3. Гидролиз соли протекает по катиону, если соль образована ____, рН = ___
4. С повышением температуры степень гидролиза (һ) ____________________
5. Гидроксильный показатель – это __________________, его математическое выражение рОН = _________________
6. Раствор гидроксида бария имеет рН = 12. Концентрация основания в растворе при 100 % диссоциации равна ________________________ моль/л
Установите соответствие:
7. между названием соли и уравнением её гидролиза по первой ступени
| Название соли | Уравнение гидролиза |
| А) сульфит натрия | 1) 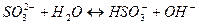
|
| Б) гидросульфит натрия | 2) 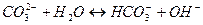
|
| В) сульфид натрия | 3) 
|
| Г) карбонат натрия | 4) 
|
5) 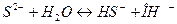
|
8. между названием веществ и продуктами их гидролиза
| Название вещества | Продукты гидролиза |
| А) ацетат аммония | 1) H3PO3 и HI |
| Б) хлор | 2) HCl и HClO |
| В) иодид фосфора (ΙΙΙ) | 3) H3PO4 и HI |
| 4) CH3COOH и NH4OH |
9. между солью и реакцией среды её водного раствора
| Название соли | Реакция среды |
| А) нитрат бария | 1) кислая |
| Б) хлорид железа (ΙΙΙ) | 2) нейтральная |
| В) сульфат аммония | 3) щелочная |
| Г) ацетат калия |
Выберите правильный вариант ответа:
10. Одним из продуктов гидролиза нитрата железа (ΙΙΙ) по второй ступени является
1) Fe(OH)2NO3 3) FeOH(NO3)2
2) FeOH(NO3) 4) Fe(OH)3
11. Кислая среда образуется при растворении в воде каждой из двух солей
1) MgSO4 и Zn(NO3)2 3) BaCl2 и AlCl3
2) K2S и K3PO4 4) CuCl2 и LiCl
12. Метилоранж желтый при растворении в воде каждой из двух солей
1) K2SO3 и Na3PO4 3) ZnCl2 и CuSO4
2) CaCl2 и FeCl3 4) Mn(NO3)2 и NaCl
13. При взаимодействии водных растворов солей сульфата хрома (ΙΙΙ) и карбоната калия, сумма коэффициентов в кратком ионном уравнении равна
1) 13 2) 15 3) 10 4) 9
14. В уравнении для расчета константы гидролиза хлорида аммония не учитывается значение концентраций
1)  2)
2)  3)
3) 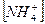 4)
4) 
Вариант № 2
Дополните:
1. В результате гидролиза соли образуется электролит ___________________
2. Степень гидролиза – это ___________________________________________
3. Гидролиз соли протекает по аниону, если соль образована _____ рН = ______
4. Чем больше Кг соли, тем __________________________________________
5. рН + рОН = ______________________________________________________
6. Раствор, в 500 мл которого растворено 1,825 г HCl, имеет рН, равный ____
Установите соответствие:
7. между названием соли и уравнением её гидролиза по первой ступени ______
| Название соли | Уравнение гидролиза |
| А) сульфат меди (ΙΙ) | 1) 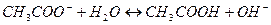
|
| Б) карбонат калия | 2) 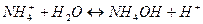
|
| В) ацетат натрия | 3) 
|
| Г) сульфат аммония | 4) 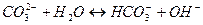
|
5) 
|
8. между названием веществ и продуктами их гидролиза
| Название вещества | Продукты гидролиза |
| А) хлорид алюминия | 1) Mg(OH)2 и NH3 |
| Б) нитрид магния | 2) HCl и Al(OH)3 |
| В) сульфид натрия | 3) H2S и NaOH |
| 4) H2SO3 и NaOH |
9. между солью и реакцией среды её водного раствора
| Название соли | Реакция среды |
| А) метасиликат натрия | 1) нейтральная |
| Б) нитрат олова (ΙΙ) | 2) кислая |
| В) бромид лития | 3) щелочная |
| Г) нитрит бария |
Выберите правильный вариант ответа:
10. Одним из продуктов гидролиза ортофосфата натрия по второй ступени является
1) NaH2PO4 3) Na2HPO4
2) H3PO4 4) NaHPO4
11. Щелочная среда образуется при растворении в воде каждой из двух солей
1) KNO3 и K3PO4 3) K2S и K3PO4
2) FeSO4 и KCl 4) K2SO4 и CH3COOK
12. Метилоранж красный при растворении в воде каждой из двух солей:
1) Fe(NO3)2 и CuSO4 3) ZnCl2 и Li2CO3
2) Na2SO4 и K2S 4) CrCl3 и KCl
13. При взаимодействии водных растворов солей сульфата алюминия и карбоната натрия, сумма коэффициентов в кратком ионном уравнении равна
1) 9 2) 10 3) 13 4) 15
14. В уравнении для расчета константы гидролиза цианида натрия не учитывается значение концентраций
1) 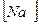 2)
2) 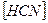 3)
3) 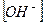 4)
4) 
Вариант № 3
Дополните:
1. Гидролизу не подвергаются соли, образованные _______________________
2. Чем больше концентрация соли, тем степень гидролиза ________________
3. При гидролизе соли среда раствора кислая, значит соль образована ______
4. Ионное произведение воды – это ____________________________________
5. Кг соли NH4Cl имеет математическое выражение ______________________
6. Раствор гидроксида калия имеет рН = 12. Концентрация основания при 100 % диссоциации равна _______________________ моль/л
Установите соответствие:
7. между названием соли и уравнением её гидролиза по второй ступени
| Название соли | Уравнение гидролиза |
| А) хлорид алюминия | 1) 
|
| Б) ортофосфат калия | 2) 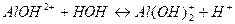
|
| В) нитрат железа (ΙΙΙ) | 3) 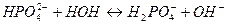
|
| Г) ортосиликат натрия | 4) 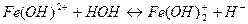
|
5) 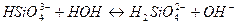
|
8. между названием веществ и продуктами их гидролиза
| Название вещества | Продукты гидролиза |
| А) гидрид калия | 1) HNO2 и NH4OH |
| Б) нитрит аммония | 2) H2S и Cr(OH)3 |
| В) сульфид хрома (ΙΙΙ) | 3) H2 и KOH |
| 4) H2SO3 и Cr(OH)3 |
9. между солью и реакцией среды её водного раствора
| Название соли | Реакция среды |
| А) ортосиликат натрия | 1) щелочная |
| Б) сульфат никеля (ΙΙ) | 2) кислая |
| В) хлорид бария | 3) нейтральная |
| Г) сульфид бария |
10. Одним из продуктов гидролиза хлорида алюминия по второй ступени является
1) AlOHCl2 3) Al(OH)2Cl
2) Al(OH)3 4) AlCl3
11. Кислая среда образуется при растворении в воде каждой из двух солей
1) Bi(NO3)3 и FeSO4 3) MgSO4 и K2SO4
2) Na2SiO3 и K2SiO3 4) MnCl2 и CaCl2
12. Фенолфталеин малиновый при растворении в воде каждой из двух солей
1) Na2SO3 и MgSO4 3) K3PO4 и Na2S
2) BaCl2 и ZnCl2 4) Na4SiO4 и CuCl2
13. При взаимодействии водных растворов солей хлорида алюминия и карбоната калия, сумма коэффициентов в кратком ионном уравнении равна
1) 15 2) 13 3) 10 4) 9
14. В уравнении для расчета константы гидролиза сульфида калия по 1-ой ступени не учитывается значение концентраций
1)  2)
2) 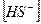 3)
3) 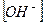 4)
4) 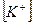
Вариант № 4
Дополните:
1. Полному гидролизу подвергаются соли ______________________________
2. Степень гидролиза зависит от следующих факторов: 1) ________ 2) ______
3) ________ 4) ______
3. Чем меньше Кд слабого электролита, тем степень гидролиза (һ) __________
4. Водородный показатель – это ___________, его математическое выражение имеет вид рН = __________________

5. Если  =
=  , то
, то 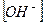 = ________________________________________
= ________________________________________
6. Раствор серной кислоты имеет рН = 1. Концентрация H2SO4 в растворе при 100% диссоциации равна_______________ моль/л
Установите соответствие:
7. между названием соли и уравнением её гидролиза по первой ступени
| Название соли | Уравнение гидролиза |
| А) хлорид железа (ΙΙΙ) | 1) 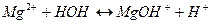
|
| Б) метасиликат натрия | 2) 
|
| В) нитрит бария | 3) 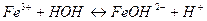
|
| Г) сульфат магния | 4) 
|
5) 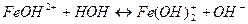
|
8. между названием веществ и продуктами их гидролиза
| Название вещества | Продукты гидролиза |
| А) карбид кальция | 1) H2S и Al(OH)3 |
| Б) сульфид алюминия | 2) HCN и NH4OH |
| В) цианид аммония | 3) C2H2 и Ca(OH)2 |
| 4) H2SO3 и Al(OH)3 |
9. между солью и реакцией среды её водного раствора
| Название соли | Реакция среды |
| А) сульфат меди (ΙΙ) | 1) нейтральная |
| Б) метасиликат калия | 2) кислая |
| В) нитрат бериллия | 3) щелочная |
| Г) нитрат бария |
Выберите правильный вариант ответа:
10. Одним из продуктов гидролиза ортосиликата калия по второй ступени является
1) K2H2SiO4 3) KH3SiO4
2) K3HSiO4 4) H4SiO4
11. Кислая среда образуется при растворении в воде каждой из двух солей
1) Fe(NO3)3 и MnSO4 3) K2SO4 и Al2(SO4)3
2) K3PO4 и Na2S 4) BaCl2 и CuCl2
12. Метилоранж желтый при растворении в воде каждой из двух солей
1) Na3PO4 и K2S 3) Na2SiO3 и FeCl3
2) Ba(NO3)2 и AlCl3 4) K2SO3 и K2SO4
13. При взаимодействии водных растворов солей хлорида хрома (ΙΙΙ) и карбоната натрия, сумма коэффициентов в кратком ионном уравнении равна
1) 13 2) 10 3) 15 4) 9
14. В уравнении для расчета константы гидролиза ацетата натрия не учитывается значение концентраций
1)  2)
2) 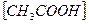 3)
3) 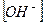 4)
4) 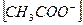
Не нашли, что искали? Воспользуйтесь поиском: