
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ГЕТЕРОЦИКЛИЧЕСКИЕ АМИНОКИСЛОТЫ
В ряду гетероциклических аминокислот встречаются следующие: пролин, оксипролин, гистидин, триптофан. Пролин и оксипролин содержат в своем составе гетероцикл — пир-ролидин, гистидин — имидазол, а триптофан - индол. Пролин и оксипролин встречаются в больших количествах в белках соединительной ткани — коллагенах. Гистидин и триптофан встречаются в небольших количествах в белках как животного, так и растительного происхождения, придавая им полноценность, так как эти аминокислоты весьма необходимы для организма.Мы рассмотрели строение аминокислот, которые получаются в результате гидролиза белковых веществ. Некоторые из этих аминокислот считаются незаменимыми, так как они не могут синтезироваться в организме человека и должны быть обязательно доставлены с пищей. К числу незаменимых аминокислот относятся триптофан, фенилаланин, треонин, метионин, лизин, валин, лейцин, изолейцин.В растениях имеются значительно больше аминокислот, они разделяются на протеиногенные и непротеиногенные, не встречающиеся в белках. К числу таких аминокислот относятся B-аланин, а-аминомасляная, а-аминовалериановая (норвалин), а-аминокап-роновая (норлейцин) и др.Аминокислоты, входящие в состав белков, можно выявить при помощи универсальной цветной реакции с нингидрином. В присутствии этого соединения все аминокислоты дают синее окрашивание, чем и пользуются для проявления аминокислот при хроматографическом анализе. Кроме того, имеются цветные реакции на отдельные аминокислоты: реактив Миллона на тирозин (смесь солей окиси и закиси ртути), реактив Адамкевича на триптофан (смесь глиоксиловой и серной кислот), реактив Фоля на цистеин (уксуснокислый свинец в щелочной среде), реактив Паули на гистидин (сульфоновая и азотная кислоты) и др. К важнейшим из них относятся: биуретовая реакция (пептидные связи), ксантопротеиновая реакция (ароматические ядра остатковтирозина, триптофана, фенилаланина), Адамкевича реакция (индольное кольцо триптофана), Миллона реакция (фенольный радикал тирозина), Паули реакция (имидазольное кольцо гистидина), Сакагучи реакция (гуанидиновая группа аргинина) и нингидриновая реакция (аминограппа).
5) Свойства пептидов
Пептиды постоянно синтезируются во всех живых организмах для регулирования физиологических процессов. Свойства пептидов зависят, главным образом, от их первичной структуры — последовательности аминокислот, а также от строения молекулы и её конфигурации в пространстве (вторичная структура).
Классификация пептидов и строение пептидной цепочки
Молекула пептида — это последовательность аминокислот: два и более аминокислотных остатка, соединённых между собой амидной связью, составляют пептид. Количество аминокислот в пептиде может сильно варьировать. И в соответствии с их количеством различают:
- олигопептиды — молекулы, содержащие до десяти аминокислотных остатков; иногда в их названии упоминается количество входящих в их состав аминокислот, например, дипептид, трипептид, пентапептид и др.;
-полипептиды — молекулы, в состав которых входит более десяти аминокислот.
Соединения, содержащие более ста аминокислотных остатков, обычно называются белками. Однако это деление условно, некоторые молекулы, например, гормон глюкагон, содержащий лишь двадцать девять аминокислот, называют белковым гормоном. По качественному составу различают:
- гомомерные пептиды — соединения, состоящие только из аминокислотных остатков;
- гетеромерные пептиды — вещества, в состав которых входят также небелковые компоненты.
Пептиды также делятся по способу связи аминокислот между собой:
- гомодетные — пептиды, аминокислотные остатки которых соединены только пептидными связями;
- гетеродетные пептиды — те соединения, в которых помимо пептидных связей встречаются ещё и дисульфидные, эфирные и тиоэфирные связи.
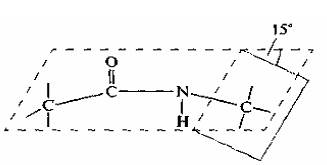
Цепочка повторяющихся атомов называется пептидным остовом: (—NH—CH—OC—). Участок (—CH—) с аминокислотным радикалом образует соединение (—NH—C(R1)H—OC—), называемое аминокислотным остатком. N-концевой аминокислотный остаток имеет свободную α-аминогруппу (—NH), в то время как у C-концевого аминокислотного остатка свободной является α-карбоксильная группа (OC—). Пептиды различаются не только по аминокислотному составу, но и по количеству, а также расположению и соединению аминокислотных остатков в полипептидную цепочку. Пример: Про-Сер-Про-Ала-Гис и Гис-Ала-Про-Сер-Про Несмотря на одинаковый количественный и качественный состав, эти пептиды имеют совершенно разные свойства.
Пептидная связь
Пептидная (амидная) связь — это вид химической связи, которая возникает вследствие взаимодействия α-аминогруппы одной аминокислоты и α-карбоксигруппы другой аминокислоты. Амидная связь очень прочная, и в нормальных клеточных условиях (37 °C, нейтральный ph) самопроизвольно не разрывается. Пептидная связь разрушается при действии на неё специальных протеолитических ферментов (протеаз, пептидгидролаз).
Значение
Пептидные гормоны и нейропептиды, например, регулируют большинство процессов организма человека, в том числе, и принимают участие в процессах регенерации клеток. Пептиды иммунологического действия защищают организм от попавших в него токсинов. Для правильной работы клеток и тканей необходимо адекватное количество пептидов. Однако с возрастом и при патологии возникает дефицит пептидов, который существенно ускоряет износ тканей, что приводит к старению всего организма. Сегодня проблему недостаточности пептидов в организме научились решать. Пептидный пул клетки восполняют синтезированными в лабораторных условиях короткими пептидами.

 OOO
OOO
 | |||||||||||
 | |||||||||||
 |  |  | |||||||||
 | |||||||||||



 Нконец-Н2N-CH-C-NH-CH-C-NH-CH-C-OH-КонецС пептидная связь
Нконец-Н2N-CH-C-NH-CH-C-NH-CH-C-OH-КонецС пептидная связь

 (CH2)2 CH3(CH2)5
(CH2)2 CH3(CH2)5
C=0
 NH2
NH2
NH2
6),7) Структура белка.
Последовательность расположения аминокислотных остатков в полипептидной цепи белковой молекулы получила название первичной структуры белка. Многократно повторяющаяся пептидная связь (-СО-NH) является типичной ковалентной связью, которая определяет первичную структуру белка. Первичная структура белка, помимо большого числа пептидных связей, обычно содержит также небольшое число дисульфидных (-S-S-) связей. Пространственная конфигурация полипептидной цепи, точнее тип полипептидной спирали, определяет вторичную структуру белка, она представлена в основном α-спиралью, которая фиксирована водородными связями. Однако оказалось, что в растворах белка спирализованная полипептидная цепочка может принимать ту или иную конфигурацию. Эта конфигурация полипептидной спирали в пространстве определяет ее третичную структуру. Другими словами, третичная структура показывает, как полипептидная цепь, свернутая целиком или частично в спираль, расположена или упакована в пространстве (в глобуле). Функциональные свойства белков определяются их конформацией, т.е. расположением полипептидной цепи в пространстве. Уникальность конформации для каждого белка определяется его первичной структурой. В белках различают два уровня конформации пептидной цепи - вторичную и третичную структуру. Вторичная структура белков обусловлена способностью групп пептидной связи к водородным взаимодействиям: C=O....HN. Пептид стремится принять конформацию с максимумом водородных связей. Однако возможность их образования ограничивается тем, что пептидная связь имеет частично двойной характер, поэтому вращение вокруг нее затруднено. Пептидная цепь приобретает не произвольную, а строго определенную конформацию, фиксируемую водородными связями.Известны несколько способов укладки полипептидной цепи: a -спираль - образуется внутрицепочечными водородными связями между NH-группой одного остатка аминокислоты и CO-группой четвертого от нее остатка; b -структура (складчатый лист) - образуется межцепочечными водородными связями или связями между участками одной полипептидной цепи изогнутой в обратном направлении; беспорядочный клубок - это участки, не имеющие правильной, периодической пространственной организации. Но конформация этих участков также строго обусловлена аминокислотной последовательностью. Содержание a -спиралей и b -структур в разных белках различно: у фибриллярных белков - только a -спираль или только b -складчатый лист; а у глобулярных белков - отдельные фрагменты полипептидной цепи: либо a -спираль, либо b -складчатый лист, либо беспорядочный клубок. Известная стабильность третичной структуры белка обеспечивается за счет водородных связей, межмолекулярных ван-дер-ваальсовых сил, электростатического взаимодействия заряженных групп и т д. Молекулы некоторых белков (например, гемоглобина) состоят из нескольких симметрично построенных частиц (одинаковых полипептидных цепей), обладающих одинаковой первичной, вторичной и третичной структурой. Совокупность таких одинаковых частиц (субъединиц), представляющая единое молекулярное образование в структурном и функциональном отношении, получила название четвертичной структуры белка. Успехи в изучении вторичной и третичной структуры белковой молекулы были достигнуты в результате применения физико-химических и особенно физических методов исследования, в частности рентгеноструктурного анализа, с использованием аппаратуры с высокой разрешающей силой и электронных счетно-решающих устройств. На основании этих данных были построено пространственные модели ряда белков, например миоглобина.Аминокислоты соединяются между собой пептидной связью с образованием пептидов и белков (n≥50). Характеристика пептидной связи. Пептидная связь плоская (копланарная). Связь С–N напоминает двойную связь (вращение невозможно) из-за сопряжение
свободной пары электронов атома азота с электронами двойной связи С=О. Пептидная связь определяет остов (хребет) первичной структуры белковой молекулы ипридает ему жесткость.
Методы изучения
Седиментационный анализ (центрифугирование) позволяет делить белки по размерам, различая белки по значению их константы седиментации, измеряемой в сведбергах и обозначаемых большой буквой S.
Методы количественного определения белков
Для определения количества белка в образце используется ряд методик:
Биуретовый метод
Микробиуретовый метод
Метод Бредфорда
Метод Лоури
Спектрофотометрический метод
8) Первичная структура белков – это последовательность аминокислот (число
которых может достигать несколько сотен и даже тысяч) в полипептидной
цепочке каждого белка.
Первичная структура стабилизируется ковалентными связями: пептидной, а в
некоторых пептидах и дисульфидной. Разрушение ковалентных связей первичной
структуры – гидролиз: 1) кислотный – в 6 н НС1, 100-110°С, 24 ч; 2) ферментатив-
ный – с помощью протеолитических ферментов в желудке при рН 1,5-5,0, в двена-
дцатиперстной кишке при рН 8,6. • Первичная структура белка является основной для формирования последующих структур белка за счет взаимодействия радикалов аминокислотных остатков полипептидной цепи. • Замена аминокислоты L-ряда на аминокислоту D-ряда или замена даже одной L-аминокислоты на другую может привести к полному исчезновению биологической активности пептида.
Вторичная структура представляет собой способ упаковки аминокислотной
цепочки в более компактную структуру. Вторичная структура получается в ре-
зультате образования водородных мостиков внутри макромолекулы или между
различными макромолекулами. Различают ά-спираль, β-структуру и неупорядочен-
ную конформацию (клубок).
9) Третичная структура – конформация полипептидной цепи в целом (т.е. располо-
жение в трехмерном пространстве). Третичную структуру стабилизируют связи
взаимодействия между радикалами аминокислотных остатков полипептидной цепи:
ковалентная – дисульфидная связь, а также водородная, ионная связи и гидрофобное
взаимодействие. Третичная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий, в которых гидрофобные взаимодействия играют важнейшую роль. В стабилизации третичной структуры принимают участие:
-ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
-ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
-водородные связи;
-гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул. Четвертичная структура белков — способ укладки в пространстве нескольких по-
липептидных цепей, обладающих первичной, вторичной и третичной структурами, с
формированием единого макромолекулярного образования для выполнения опреде-
ленной функции. Четвертичной структурой обладают белки с молекулярной массой бо-
лее 50 000.
фо́лдингом белка (укладкой белка, от англ. folding) называют процесс спонтанного сворачивания полипептидной цепи в уникальную нативную пространственную структуру (так называемая третичная структура). Нативная структура белка. Многие белки в третичной структуре имеют спирализованные, складчатые и неупорядоченные сегменты. При этом в функциональном и
структурном отношениях важно взаимное расположение аминокислотных радикалов.
Для выполнения функции белок должен иметь определенную и часто единственную
третичную структуру (конформацию) – нативную структуру. Механизм сворачивания белков до конца не изучен. Экспериментальное определение трёхмерной структуры белка часто очень сложно и дорого. Однако аминокислотная последовательность белка обычно известна. Поэтому учёные пытаются использовать различные биофизические методы, чтобы предсказать пространственную структуру белка из его первичной аминокислотной последовательности.
10) Четвертичная структура (или субъединичная, доменная) — взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса. Белковые молекулы, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности и лишь после окончания синтеза образуют общую надмолекулярную структуру. В состав белка с четвертичной структурой могут входить как идентичные, так и различающиеся полипептидные цепочки. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул. Четвертичная структура белков — способ укладки в пространстве нескольких полипептидных цепей, обладающих первичной, вторичной и третичной структурами, с
формированием единого макромолекулярного образования для выполнения опреде-
ленной функции. Четвертичной структурой обладают белки с молекулярной массой бо-
лее 50 000.
Многие белки имеют в своем составе несколько полипептидных цепей. Такие белки называют олигомерными, а отдельные цепи — протомерами.
Протомеры в олигомерном белке соединены множеством слабых, нековалентных связей (гидрофобных, ионных, водородных).Взаимодействие протомеров осуществляется благодаря комплементарности их контактирующих поверхностей. Гемоглобин — олигомерный белок, функция которого регулируется различными лигандами.Также олигомерные ферменты:лактатдегидрогеназа,фосфорилаза.
надмолекулярные белковые комплексы: Белковые цепи, которые входят в состав белка с четвертичной структурой, лишь после окончания синтеза образуют надмолекулярную структуру. Сложную молекулу, где полипептидные цепи соединены дисульфидными мостиками. Надмолекулярные белковые комплексы могут состоять из десятков молекул. Многие комплексы сравнимы с рибосомами по размеру. Крупные надмолекулярные белковые комплексы являются самоорганизующимися системами. Характерный пример такого рода - система синтеза жирных кислот (из дрожжей), состоящая из 7 различных ферментов. Каждый из этих ферментов, в свою очередь, построен из 3 - х, по-видимому, идентичных субъединиц.
11) Физико-химические св-ва белков
1 Наиболее характерными физико-химическими свойствами белков являются: высокая вязкость растворов,
незначительная диффузия, способность к набуханию в больших пределах, оптическая активность, подвижность в электрическом поле, низкое осмотическое давление и высокое онкотическое давление, способность к поглощению Уф-лучей при 280 нм (это последнее свойство, обусловленное наличием в белках ароматических аминокислот, используется для количественного определения белков).
Белки, как и аминокислоты, амфотерны благодаря наличию свободных NH2-и СООН-групп и характеризуются соответственно всеми св-вами кислот и оснований.
Белки обладают явно выраженными гидрофильными свойствами. Их растворы обладают очень низким осмотическим давлением, высокой вязкостью и незначительной способностью к диффузии. Белки способны к набуханию в очень больших пределах.
С коллоидным состоянием белков связан рад характерных свойств, в частности явление светорассеяния, лежащее в основе количественного определения белков методом нефелометрии. Этот эффект используется, кроме того, в современных методах, микроскопии биологических объектов. Молекулы белка не способны проходить через, полупроницаемые искусственные мембраны (целлофан, пергамент, коллодий), а также биомембраны растительных и животных тканей, хотя при органических поражениях, например почек, капсула почечного клубочка (Шумлянского -Боумена) становится проницаемой для альбуминов сыворотки крови, и они появляются в моче.
Денатурация белка под влиянием различных физических и химических факторов белки подвергаются свертыванию и выпадают в осадок, теряя нативные свойства. Таким образом, под денатурацией следует понимать нарушение общего плана - уникальной структуры нативной молекулы белка, приводящее к потере характерных для нее свойств (рас-творимости, злектрофоретической подвижности, биологической активности и т. д.). Большинство белков денатурируют при нагревании их раствором выше 50-60о С. Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-rpyпп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической антигенной или гормональной) При денатурации разрушаются в основном нековалентные (в частности, водородные) связи и дисульфидные мостики и не затрагиваются пептидные связи самого остова полипептидной цепи При этом развертываются глобулы нативных белковых молекул и образуются случайные и беспорядочные структуры.
Денатурация
Белковая молекула имеет нативную (функциональную) конформацию благодаря наличию большого числа слабых связей и быстро денатурирует при изменении условий среды, от которых эти силы зависят. Изменение температуры, ионной силы, рН, а также обработка органическими или некоторыми дестабилизирующими агентами может привести к нарушению нативной конформации, что и называется денатурацией. Денатурирующие вещества образуют связи с аминогруппами или карбонильными группами пептидного остова или некоторыми боковыми остатками аминокислот, подменяя собственные внутримолекулярные связи в белке, вследствие чего вторичная и третичная структуры изменяются. Эти изменения не затрагивают первичную структуру, при этом биологическая активность белка утрачивается.
Ренатурация
Ренатурация (высаливание) — процесс, обратный денатурации, при котором белки возвращают свою природную структуру. Нужно отметить, что не все белки способны ренатурировать; у большинства белков денатурация необратима. При определенных условиях денатурированный белок может быть ренативирован. Это происходит при удалении денатурирующего или дестабилизирующего фактора. Например, при удалении мочевины диализом полипептиды самопроизвольно восстанавливают свою нативную конформацию. То же происходит при медленном охлаждении денатурированного нагреванием белка.
12) Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apr и Гис.
Степень ионизации функциональных групп этих радикалов зависит от рН среды. При рН раствора около 7 все ионогенные группы белка находятся в ионизированном состоянии. В кислой среде увеличение концентрации протонов (Н+) приводит к подавлению диссоциации карбоксильных групп и уменьшению отрицательного заряда белков: -СОО- + Н+ → -СООН. В щелочной среде связывание избытка ОН" с протонами, образующимися при диссоциации NH3+с образованием воды, приводит к уменьшению положительного заряда белков:-NH3+ +ОН- → -NH2 + H2O.
Значение рН, при котором белок приобретает суммарный нулевой заряд, называют "изоэлектрическая точка" и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии.
Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина.
Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (-). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.При смещении рН в растворе изменяется концентрация ионов Н+. При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным.
При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
13) Все белки принято делить на простые белки,или протеины, и сложные белки, или протеиды (комплексы бел-ков с небелковыми соединениями).Простые белки являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической груп-пы.ФосфопротеиныИмеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Метал-лопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молибден, реже марганец, никель. ГликопротеиныПростетическая группа представлена углеводами и их производными. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. ЛипопротеиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов.К белкам этого класса относятся казеиноген молока, в котором содержание фосфорной кислоты достигает 1%; и др. Большое количество фосфопротеинов содер-жится в клетках ЦНС. Характерной особенностью структуры фосфопротеинов является то, что фосфорная кислота ока-зывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиаминокислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата. Фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функ-ций. Кроме того, они являются ценным источником энергетиче-ского и пластического материала в процессе эмбриогенеза и дальнейшего постна-тального роста и развития организма.
Липопротеи́ны (липопротеиды) — класс сложных белков, простетическая группа которых представлена каким-либо липидом. Так, в составе липопротеинов могут быть свободные жирные кислоты, нейтральные жиры, фосфолипиды, холестериды.
Липопротеины представляют собой комплексы, состоящие из белков (аполипопротеинов; сокращенно — апо-ЛП) и липидов, связь между которыми осуществляется посредством гидрофобных и электростатических взаимодействий.
Липопротеины подразделяют на свободные, или растворимые в воде (липопротеины плазмы крови, молока и др.), и нерастворимые, т. н. структурные (липопротеины мембран клетки, миелиновой оболочки нервных волокон, хлоропластов растений).
Среди свободных липопротеинов (они занимают ключевое положение в транспорте и метаболизме липидов) наиболее изучены липопротеины плазмы крови, которые классифицируют по их плотности. Чем выше содержание в них липидов, тем ниже плотность липопротеинов. Различают липопротеины очень низкой плотности (ЛПОНП), низкой плотности (ЛПНП), высокой плотности (ЛПВП) и хиломикроны. Каждая группа липопротеинов очень неоднородна по размерам частиц (наиболее крупные — хиломикроны) и содержанию в ней апо-липопротеинов. Все группы липопротеинов плазмы содержат полярные и неполярные липиды в разных соотношениях.Нековалентная связь в липопротеинах между белками и липидами имеет важное биологическое значение. Она обусловливает возможность свободного обмена липидов и модуляцию свойств липопротеинов в организме.
Липопротеины являются:
-структурными элементами мембран клеток животных организмов;
-транспортными белками, транспортирующими холестерин и другие стероиды, фосфолипиды и др.
14) Все белки принято делить на простые белки,или протеины, и сложные белки, или протеиды (комплексы бел-ков с небелковыми соединениями).Простые белки являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической груп-пы.ФосфопротеиныИмеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Метал-лопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молибден, реже марганец, никель. ГликопротеиныПростетическая группа представлена углеводами и их производными. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. ЛипопротеиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов.К белкам этого класса относятся казеиноген молока, в котором содержание фосфорной кислоты достигает 1%; и др. Большое количество фосфопротеинов содер-жится в клетках ЦНС. Характерной особенностью структуры фосфопротеинов является то, что фосфорная кислота ока-зывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиаминокислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата. Фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функ-ций. Кроме того, они являются ценным источником энергетиче-ского и пластического материала в процессе эмбриогенеза и дальнейшего постна-тального роста и развития организма.
Хромопротеины (от греч. chroma – краска) состоят из простого белка и связанного с ним окрашенного небелкового компонента. Различают гемопротеины (содержат в качестве простетической группы железо), маг-нийпорфирины и флавопротеины (содержат производные изоаллоксазина). Хромопротеины наделены рядом уникальных биологических функций: они участвуют в таких фундаментальных процессах жизнедеятельности, как фо-тосинтез, дыхание клеток и целостного организма, транспорт кислорода и диоксида углерода, окислительно-восстанови-тельные реакции, свето-и цветовосприятие и др. Таким образом, хромопротеины играют исключительно важную роль в процессах жизнедеятельности. Например, подавление дыхательной функции гемоглобина путем введения оксида углерода (СО) либо утили-зации (потребление) кислорода в тканях путем введения синильной кислоты или ее солей (цианидов), ингибирующих ферментные системы клеточного дыхания, моментально приводит к смерти организма. Хромопротеины являются непременными и активными участниками аккумулирования энергии, начиная от фиксации солнечной энергии в зеленых растениях и утилизации ее до превращений в организме животных и человека. Хлорофилл (магнийпорфирин) вместе с белком обеспечивает фо-тосинтетическую активность растений, катализируя расщепление молекулы воды на водород и кислород (поглоще-нием солнечной энергии). ГЕМОГЛОБИН осн. белок дыхат. цикла, участвующий в переносе О2 от органов дыхания к тканям, а в обратном направлении - СО2. Содержится в эритроцитах крови почти всех позвоночных и гемолимфе большинства беспозвоночных животных. Гемоглобин взрослого человека (НbА) имеет мол.м. 6,49*104 и принадлежит к числу наиб. изученных белков. Его форма в р-ре близка к эллипсоиду с осями 6,4, 5,5 и 5,0 нм; изоэлектрич. точка 6,9. Тетрамер НЬА состоит из двух и двухсубъединиц, их полипептидные цепи содержат соотв. 141 и 146 аминокислотных остатков. Известны первичная структура обеих цепей, а также пространств.структура оксигенированной, дезоксигенированной, ряда лигандированных, а также окисленной формы (содержит Fe3 +) НbА. Пространств. структура субъединиц (рис. 1) характеризуется наличием восьмиспиральных участков, включающих около 80% аминокислотных остатков, и внутр. полости -гемового кармана. Фиксирование тема в субъединице осуществляется в результате гидрофобных взаимод. пиррольных и винильных групп тема с алифатич. и ароматич. боковыми радикалами аминокислот, выстилающими полость кармана, а также благодаря координационной связи (направлена перпендикулярно к плоскости кольца тема) Fe2+ с аксиальным лигандом-имидазольной группой гистидина.
15) Все белки принято делить на простые белки,или протеины, и сложные белки, или протеиды (комплексы бел-ков с небелковыми соединениями).Простые белки являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической груп-пы.ФосфопротеиныИмеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Метал-лопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молибден, реже марганец, никель. ГликопротеиныПростетическая группа представлена углеводами и их производными. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. ЛипопротеиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов.К белкам этого класса относятся казеиноген молока, в котором содержание фосфорной кислоты достигает 1%; и др. Большое количество фосфопротеинов содер-жится в клетках ЦНС. Характерной особенностью структуры фосфопротеинов является то, что фосфорная кислота ока-зывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиаминокислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата. Фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функ-ций. Кроме того, они являются ценным источником энергетиче-ского и пластического материала в процессе эмбриогенеза и дальнейшего постна-тального роста и развития организма.
ликопротеи́ны (устар. гликопротеиды) — это сложные белки, в которых белковая (пептидная) часть молекулы ковалентно соединена с одной или несколькими группами гетероолигосахаридов. Кроме гликопротеинов существуют также протеогликаны и гликозаминогликаны
Моносахариды, связанные с конкретным белком, могут быть разными: это может быть глюкоза, фукоза, манноза, глюкозамин, галактозамин, ксилоза, сиаловая кислота, галактоза и др.
Те или иные моносахариды, связанные с белком, изменяют биохимические и иммунологические свойства белка, его пространственную конфигурацию и др. Важным частным случаем является связывание белков с сиаловой кислотой, приводящее к формированию сиалогликопротеинов. В типичных случаях именно связывание с сиаловой кислотой предопределяет увеличение T1/2 белка в плазме крови.Гликопротеины являются важным структурным компонентом клеточных мембран животных и растительных организмов. К гликопротеинам относятся большинство белковых гормонов. Гликопротеины мембран эритроцитов, специфически гликозилированные теми или иными углеводными остатками, но имеющие гомологичную белковую часть, предопределяют группу крови у человека. Также гликопротеинами являются все антитела, интерфероны, компоненты комплемента, белки плазмы крови, молока, рецепторные белки и др.
16) Все белки принято делить на простые белки,или протеины, и сложные белки, или протеиды (комплексы бел-ков с небелковыми соединениями).Простые белки являются полимерами только аминокислот; сложные, помимо остатков аминокислот, содержат также небелковые, так называемые простетические группы.Сложные белки делят на ряд классов в зависимости от характера простетической груп-пы.ФосфопротеиныИмеют в качестве небелкового компонента фосфорную кислоту. Представителями данных белков являются казеиноген молока, вителлин (белок желтков яиц). Метал-лопротеиныСодержат катионы одного или нескольких металлов. Наиболее часто это -- железо, медь, цинк, молибден, реже марганец, никель. ГликопротеиныПростетическая группа представлена углеводами и их производными. Нуклеопротеины. Роль протеистической группы выполняет ДНК или РНК. Белковая часть представлена в основном гистонами и протаминами. ЛипопротеиныСложные белки, простетическая группа которых образована липидами. Основная функция липопротеинов -- транспорт по крови липидов.К белкам этого класса относятся казеиноген молока, в котором содержание фосфорной кислоты достигает 1%; и др. Большое количество фосфопротеинов содер-жится в клетках ЦНС. Характерной особенностью структуры фосфопротеинов является то, что фосфорная кислота ока-зывается связанной сложноэфирной связью с белковой молекулой через гидроксильные группы β-оксиаминокислот, главным образом серина и в меньшей степени треонина. На одну молекулу белка обычно приходится 2–4 остатка фосфата. Фосфопротеины содержат органически связанный, лабильный фосфат, абсолютно необходимый для выполнения клеткой ряда биологических функ-ций. Кроме того, они являются ценным источником энергетиче-ского и пластического материала в процессе эмбриогенеза и дальнейшего постна-тального роста и развития организма.
Нуклеопротеиды — комплексы нуклеиновых кислот с белками.К нуклеопротеидам относятся устойчивые комплексы нуклеиновых кислот с белками, длительное время существующие в клетке в составе органелл или структурных элементов клетки в отличие от разнообразных короткоживущих промежуточных комплексов белок — нуклеиновая кислота (комплексы нуклеиновых кислот с ферментами — синтетазами и гидролазами — при синтезе и деградации нуклеиновых кислот, комплексы нуклеиновых кислот с регуляторными белками и т. п.).
В зависимости от типа входящих в состав нуклеопротеидных комплексов нуклеиновых кислот различают рибонуклеопротеиды и дезоксирибонуклеопротеиды.Устойчивость нуклеопротеидных комплексов обеспечивается нековалентным взаимодействием. У различных нуклеопротеидов в обеспечение стабильности комплекса вносят вклад различные типы взаимодействий, при этом нуклеиново-белковые взаимодействия могут быть специфичными и неспецифичными. В случае специфичного взаимодействия определённый участок белка связан со специфичной (комплементарной участку) нуклеотидной последовательностью, в этом случае вклад водородных связей, образующихся между нуклеотидными и аминокислотными остатками благодаря пространственному взаимному соответствию фрагментов, максимален. В случае неспецифичного взаимодействия основной вклад в стабильность комплекса вносит электростатическое взаимодействие отрицательно заряженных фосфатных групп полианиона нуклеиновой кислоты с положительно заряженными аминокислотными остатками белка.Примером специфичного взаимодействия могут служить нуклеопротеидные комплексы рРНК — субъединицы рибосом; неспецифичное электростатическое взаимодействие характерно для хромосомных комплексов ДНК — хроматина и комплексов ДНК-протамины головок сперматозоидов некоторых животных.
Нуклеопротеиды диссоциируют на белки и нуклеиновые кислоты при воздействии агентов, разрушающих или ослабляющих нековалентные связи:-повышенные концентрации солей или мочевины, увеличивающих ионную силу раствора,-ионогенные поверхностно-активные вещества,
-некоторые полярные органические соединения (формамид и диметилформамид, фенол и т. п.).
Некоторые нуклеопротеиды (рибосомные субчастицы, нуклеокапсиды вирусов) обладают способностью к самосборке, то есть к образованию, при соответствующих условиях, нуклеопротеидов in vitro без участия клеточных структур или агентов; такая самосборка возможна в случае специфичных нуклеиново-белковых взаимодействий (нуклеиново-белковым узнавании). В любом случае, при образовании нуклеопротеидов происходят существенные конформационные изменения нуклеиновых кислот и, в некоторых случаях, белков, образующих нуклеопротеидный комплекс. Дезоксирибонуклеопротеиды-хроматин, Рибонуклеопротеиды
17),18) После достижения полной экстракции белков, т.е. перевода белков в растворенное состояние, приступают к разделению – фракционированию смеси белков на индивидуальные белки. Для этого применяют разнообразные методы: высаливание, тепловую денатурацию, осаждение органическими растворителями, хроматографию, электрофорез, распределение в двухфазных системах, кристаллизацию и др.
Хроматография. Принцип хроматографии, разработанный в 1903 г. русским ученым М. С. Цветом, основан на способности пигментов (или любых других окрашенных и неокрашенных веществ) специфически адсорбироваться на адсорбенте, заключенном в колонке.
В результате происходит разделение анализируемых веществ и их концентрирование в строго определенном слое адсорбента. Затем через колонку пропускают подходящие элюенты, которые ослабляют силы адсорбции и выносят с током раствора индивидуальные вещества. Последние последовательно собирают в коллекторе фракций (принцип сорбции-десорбции).
Чрезвычайно эффективным средством фракционирования белков из смеси оказалась колоночная хроматография с гидроксилапатитом, различными ионообменными смолами и производными целллюлозы в качестве носителей. При выделении и очистке белков используют четыре основных типа хроматографии: адсорбционную, распределительную, ионообменную и аффинную (хроматография по сродству) – в соответствии с разными физическими и химическими механизмами, лежащими в основе каждого из них. Хроматография широко применяется не только для выделения белков, но и для разделения множества других органических и неорганических веществ, входящих в состав живых организмов.так же есть хромотография на бумаге,распределительная,адсорбционная,афинная.
Электрофорез. Метод свободного электрофореза, детально разработанный лауреатом Нобелевской премии А. Тизелиусом, основан на различии в скорости движения (подвижности) белков в электрическом поле, которая определяется величиной заряда белка при определенных значениях рН и ионной силы раствора. В последнее время более широкое распространение получили методы зонального электрофореза белков на различных носителях, в частности на твердых поддерживающих средах: гелях крахмала и полиакриламида, целлюлозе. Преимущества их по сравнению с методом свободного электрофореза состоят в том, что исключается размывание границы белок-растворитель в результате диффузии и конвекции, не требуется налаживания сложной аппаратуры для определения положения границы, а для анализа необходимо небольшое количество белка.
Не нашли, что искали? Воспользуйтесь поиском: