
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Приготування буферних розчинів із заданим рН
Буферний розчин із заданим рН з відомою парою буферуючих компонентів можна приготувати трьома способами:
- змішуючи в необхідному співвідношенні кількості речовини; розчини слабкої кислоти і розчинної солі цієї кислоти («кислотою» може виступати кисла сіль багатоосновної кислоти);
- змішуючи в необхідному співвідношенні кількості речовини; розчин слабкої кислоти і розчин лугу;
- змішуючи в необхідному співвідношенні кількості речовини; розчин солі слабкої кислоти і розчинн сильної кислоти.
Приклад 3. У якому співвідношенні треба змішати розчини, щоб отримати буфер з рН = 5,0?
1) 0,20 моль/л NaAc і 0,15 моль/л НAc;
2) 0,20 моль/л NaAc і 0,15 моль/л НCl;
3) 0,20 моль/л NaOH і 0,15 моль/л НAc.
Розв’язання.
1) За схемою М. П. Комаря.
Hac D Ac- + H+ lgKа = 4,76,
c 0, 15·VHac 0,20·VNaac
VHac+VNaac VHac+VNaac
Δ с -х х х
[ ] c Hac - x c Naac + x x
Знехтувавши змінами введених концентрацій кислоти і солі, враховуючи, що x = 10-рН = 10-5 , зробимо підстановку в вираз константи ЗДМ і прологарифмуємо з негативним знаком.
pH – pKa = lg 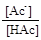 ;
;
5,0 – 4,76 = lg 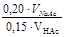 ;
;
100,24 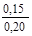 =
=  ;
;
 = 1,30.
= 1,30.
Відповідь. Для приготування буферного розчину з рН = 5,0 треба змішати 0,15 моль/л НAc і 0,20 моль/л NaAc у співвідношенні 1:1,3 (або до 100 мл 0,15 моль/л Нac додати 130 мл 0,20 моль/л NaAc).
2) Розглянемо рівняння реакції протонування ацетат-іона.
Ac- + H+ D HAc KH = 104,76
n 0,20·VNaAc 0,15·VHCl -
Після змішувння розчинів
c Ас = (0,20·VNaAc − 0,15·VHCl)/ (VNaAc + VHCl);
с HAc = 0,15·VHCl / (VNaAc + VHCl);
c c Ас - с HAc
Δc x x -x
[ ] c Ас+ x x с HAc −x
x = 10-5; c Ас+ x= c Ас; с HAc −x= с HAc. Підставляємо в ЗДМ:
 ;
;
100,24 = 1,333 VNaAc /VHCl –1,0;

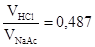 .
.
Відповідь. Для приготування буферного розчину з рН = 5,0 треба змішати 0,15 моль/л НCl і 0,20 моль/л NaAc у співвідношенні 1:2,05 або до 100 мл 0,20 моль/л NaAc додати 48,7 мл 0,15 моль/л НСl.
3) Розглянемо рівняння реакції нейтралізації HAc розчином NaOH.
НAc + OH- D Ac- + H2O KaKw-1 = 109,24
n 0,15·VHAc 0,20·VNaOH -
Після змішувння розчинів
c Ас = 0,20·VNaOH / (VNaOH + VHAc);
с HAc = (0,15·VHAc − 0,20·VNaOH)/ (VNaAc + VHCl);
c cH Ас - с Ac-
Δc x x -x
[ ] cH Ас+ x x с Ac −x
x = Kw / [H+] = 10-14/10-5= 10-9; cH Ас+ x= cH Ас; с Ac −x= с Ac. Підставляємо в ЗДМ
 ;
;
109.24-9,0 = 100,24 =  ;
;
 ;
;
 .
.
Відповідь. Для приготування буферного розчину з рН = 5,0 треба змішати 0,15 моль/л НAc і 0,20 моль/л NaOH у співвідношенні 2,10:1 (або до 100 мл 0,15 моль/л HAc додати 47,6 мл 0,20 моль/л NaOH.
Не нашли, что искали? Воспользуйтесь поиском: