
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Спектральный анализ
ИМА. Вопросы к экзамену и экзаменационные билеты в 2012 г
Источники: 1. Круглов В.С. Лабораторный практикум по ИМА, ИАТЭ; 2. Лекции; 3. Физический энциклопедический словарь; 4. Дикерсон и др. Основные законы химии; 5. Юинг Г. Инструментальные методы химического анализа; 6.Золотов Ю.А. Основы аналитической химии, т.2; 7. Харитонов Ю.Я. Аналитическая химия (аналитика), кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа.
8. Химический энциклопедический словарь. 9. М.Фримантл. Химия в действии. Т.2. М.Мир, 1991.
Исправления и дополнения 25.05.12.
Спектральный анализ
Шкала ЭМИ.
Источники ЭМИ.
Е кванта→
n →
← λ
| 105 | 3∙10-4 | 8∙10-7 | 4∙10-7 | 10-8 | 10-12 | l, м | |||||||||||||
| Радиочастотная область | Микроволновая область | Инфракрасная область | Видимое излучение | Ультрафиолетовая область | Рентгеновское излучение | g - излучение космические лучи | |||||||||||||
Величины, используемые в спектральном анализе. Связи между ними. РРазмерности.
Спектральный анализ. Классификация спектрального анализа по целям анализа и типам спектров. Атомный спектральный анализ определяет -…; молекулярный спектральный анализ определяет …. Эмиссионный спектральный анализ - …;. аАбсорбционный спектральный анализ - ….
СНепрерывные, линейчатые спектры излучения и поглощения: линейчатые, полосатые, непрерывные. Ширина спектральной линии. Причины уширения спектральной линии: 1) …; 2) …. Причины появления полос в спектре.
Спектральные линии - …. Спектральные линии уширяются вследствие … (доплеровское уширение). Спектральную линию приближенно считают монохроматической с длиной волны, отвечающей …. Спектральная линия характеризуется … и …
Спектр - …
Атомные спектры. Атомные спектры возникаютполучаются при …. Атомные спектры линейчатые, т.к. состоят из спектральных линий, характеризуемых частотой ν излучения, которая соответствует определенному квантовому переходу электронов между уровнями энергии E n и E m атома согласно соотношению ….

Спектральнуюые линиюи характеризуют …частотой λ, длиной волны λ, волновым числом  , энергией фотона
, энергией фотона  , интенсивностью I (укажите пять характеристик). Атомные спектры обладают ярко выраженной индивидуальностью (они (разные, одинаковые) для атомов разных элементов). При изучении атомных спектров принимается во внимание, что их вид определяется не только электронным строением атома данного элемента, но и внешними факторами: температурой, давлением, электрическими и магнитными полями. Атомные спектры наблюдаются в …УФ, …видимой и …ИК областях спектра ЭМИ. Атомные спектры испускания (эмиссионные атомные спектры) получают при …возбуждении атома различными способами: при облучении его светом, пучком электронов и т.п. Атомные спектры поглощения (абсорбционные атомные спектры) получают при …прохождении излучения непрерывного спектра через атомные газы или пары. Атомные спектры получают и наблюдают с помощью …спектральных приборов.
, интенсивностью I (укажите пять характеристик). Атомные спектры обладают ярко выраженной индивидуальностью (они (разные, одинаковые) для атомов разных элементов). При изучении атомных спектров принимается во внимание, что их вид определяется не только электронным строением атома данного элемента, но и внешними факторами: температурой, давлением, электрическими и магнитными полями. Атомные спектры наблюдаются в …УФ, …видимой и …ИК областях спектра ЭМИ. Атомные спектры испускания (эмиссионные атомные спектры) получают при …возбуждении атома различными способами: при облучении его светом, пучком электронов и т.п. Атомные спектры поглощения (абсорбционные атомные спектры) получают при …прохождении излучения непрерывного спектра через атомные газы или пары. Атомные спектры получают и наблюдают с помощью …спектральных приборов.
Линейчатый спектр водородоподобных атомов (атомов и ионов с одним электроном в электронной оболочке: H, He+, Li2+, Be3+,...) описывается простой формулой …,

где …  – волновое число линии; R – постоянная Ридберга (R = 10973731.77 ± 0.83 м-1); Z – атомный номер водородоподобного атома; nl и n k – целые числа, определяющие начальный и конечный уровни энергии электрона в атоме (nl < n k). См. рис.1 и 2. Приведите в качестве примера правдоподобный спектр атомарного водорода.
– волновое число линии; R – постоянная Ридберга (R = 10973731.77 ± 0.83 м-1); Z – атомный номер водородоподобного атома; nl и n k – целые числа, определяющие начальный и конечный уровни энергии электрона в атоме (nl < n k). См. рис.1 и 2. Приведите в качестве примера правдоподобный спектр атомарного водорода.

ИзобразитеРис.1. сСхемуа электронных уровней атомарного водорода (Z = 1).

Рис.2. Спектр атомарного водорода.
Атомно-абсорбционная спектроскопия (ААС). [8], с.59. Метод элементного анализа и исследования вещества по атомным спектрам поглощения. Длянаблюдения этих спектров через атомный пар пробы пропускают …. через атомный пар пробы пропускают видимое или УФ излучение. В результате поглощения квантов излучения электроны содержащихся в паре атомов переходят с нижних энергетических уровней на возбужденные. Этим переходам в атомном спектре соответствуют так называемые резонансные линии, характерные для данного элемента. Исследуемое вещество атомизируют, распыляя его раствор в пламя газовой горелки. Световой поток после прохождения через поглощающий слой атомного пара и монохроматор, выделяющий резонансную линию, регистрируют фотоэлектрически. В соответствии с законом Бугера-Ламберта-Бэра Ммерой концентрации элемента в пробе служит …доля поглощенной энергии квантов с резонансной частотой. Атомный абсорбционный анализ применяется для …определения как следов вещества (до 10-6%) так и макроколичеств приблизительно 70 элементов в различных объектах - воде, почве, продуктах питания, нефтях, минералах, сплавах..
Молекулярные спектры - это. [1], с.40. Спектры испускания, поглощения и комбинационного рассеяния света (КРС), принадлежащие свободным или слабо связанным между собой молекулам спектры … и КРС (расшифруйте абревиатуру), принадлежащие молекулам, которые (слабо, сильно) связаны между собой.. Типичные молекулярные спектры – (линейчатые, полосатые)полосатые.. Они наблюдаются в виде совокупности …более или менее узких полос в в … УФ, …видимой и …ИК областях спектра. При достаточной разрешающей способности спектральных приборов полосы в молекулярных спектрах распадаются на …совокупность тесно расположенных линий (полосы состоят из большого числа тесно расположенных спектральных линий).
Линии в полосах молекулярных спектров возникают при квантовых переходах между уровнями энергии согласно соотношению …,
где …. При КРС энергия hν равна разности энергий падающего и … фотонов.

где hν - энергия испускаемого или поглощаемого фотона частоты ν. При КРС hν равна разности энергий падающего и рассеянного фотонов. Молекулярные спектры гораздо сложнее атомных спектров, что определяется большей сложностью внутренних движений в молекуле, т.к. кроме движения электронов относительно двух и более ядер в молекуле происходит также колебательное движение ядер (вместе с окружающими их внутренними электронами) около положения равновесия и вращательного движения молекулы как целого. Электронному, колебательному и вращательному движениям молекулы соответствуют три типа уровней энергии: εэл, εкол и εвр и три типа молекулярных спектров. Согласно квантовой механике энергия всех видов движения в молекуле может принимать только определенные значения (квантуется). См. рис. Ниже на стр.5.
Молекулы имеют квантованные …электронные энергетические уровни, …колебательные энергетические уровни и вращательныевращательные энергетические уровни. Переходы между вращательными уровнями соответствуют энергиям …микроволновой области спектра, переходы между колебательными уровнями – …инфракрасной области, переходы между электронными уровнями – …видимой и …ультрафиолетовой областям спектра. Инфракрасная спектроскопия и спектроскопия комбинационного рассеяния используется для наблюдения внутримолекулярных колебательных переходов. Поглощение света молекулами в видимой и ультрафиолетовой частях спектра обусловлено …электронными переходами. График зависимости интенсивности этого поглощения от длины волны света называется спектром поглощения. [4], т.1, стр.506.
Электронные, вращательные, колебательные спектры атомов и молекул. Энергии квантовых переходов.
Электронным, колебательным и вращательным переходам в молекулах соответствуют энергии соответственно 40 …- 400; …0.5 - 40; …≤ 0.5 кДж/моль. [1], с.41.
| Энергетические уровни перехода | Энергия квантов, кДж/моль |
| Электронные | …40 - 400 |
| Колебательные | …0.5 - 40 |
| Вращательные | …< 0.5 |
Три параметра, которыми характеризуют спектральную полосу (полосы в спектрах, возникающих при электронных, колебательных, вращательных переходах в молекулах - молекулярныхе спектрахы): 1) … λ max –длина волны квантов,, 2) I max - …, 3) Δ λ - …. которым соответствует максимальная интенсивность I max, Δ λ - ширина полосы на половинной высоте пика. Приведите рисунок.

Приведите Рис. сСхемуа энергетических уровней двухатомной молекулы, включающих: Е е - уровни электронной энергии Е е (на рисунке Е 0 и Е 1); Еv – уровни колебательной энергии Еv (vibration – вибрация, колебание) (на рисунке Еv0, Еv1, Еv2 и Еv3); Е r – уровни вращательной энергии Е r. Покажите на этой схеме примеры переходов (rotation –вращение) (на рисунке Е r0, Е r1, …, Е r6); (vr – переходы, соответствующие вращательному спектру;
vv r - переходы, соответствующие колебательно-вращательному спектру; vevr – переходы, соответствующие электронно – колебательно - вращательному спектру). Совокупность всех этих переходов образует полосатый молекулярный спектр. Близко расположенные линии электронно – колебательно – вращательного спектра при недостаточном разрешении спектрального прибора сливаются в полосы. [Золотов], с.207.

Интенсивность спектральной линии. Если энергию фотона Е (или λ, или ν, или  ) определяет положение спектральной линии в спектре, то их число - ее интенсивность. В спектроскопии под интенсивностью линии понимают энергию, испускаемую, поглощаемую или рассеиваемую в единицу времени. [Золотов], с. 203.
) определяет положение спектральной линии в спектре, то их число - ее интенсивность. В спектроскопии под интенсивностью линии понимают энергию, испускаемую, поглощаемую или рассеиваемую в единицу времени. [Золотов], с. 203.
Чем отличаются фотоколориметрический и спектрофотометрический методы? [1], с.44. Фотоколориметрический метод основан на измерении поглощения веществом полихроматического света, выделяемого из сплошного спектра излучения внешнего источника с помощью светофильтра. Ширина вырезаемого с помощью светофильтра спектрального диапазона Δ λ составляет 20 -100 нм. Спектрофотометрический анализ основан на регистрации и измерении поглощения монохроматического излучения (интервал Δ λ значительно уже: 1 - 2 нм).
Приведите выражения для оптической плотности D и оптического пропускания T:
…,.
 (*)
(*)
где … I 0 – интенсивность луча, прошедшего через кювету с растворителем; I – интенсивность
луча, прошедшего через кювету с растворителем и растворенным в нем исследуемым веществом. Обратите внимание - в формуле (*) логарифм десятичный! Если в (*) концентрация с исследуемого вещества выражена в моль/л, длина пути l луча в поглощающей среде – в см, то коэффициент поглощения k (ν) обозначают символом ε λ и называют молярным коэффициентом поглощения (или коэффициентом экстинкции). Молярный коэффициент поглощения ε λ зависит от λ и от химической природы и состояния вещества.
[ ε λ] = л/(моль∙см). [1], с.44, 49.
Молярный коэффициент ε λ ε λ поглощения вещества - это …. Размерность. Приведите правдоподобный график зЗависимостиь ε λ от λ.

Рис. Спектрофотометримческий анализ. Изобразите правдоподобный вид Ультрафиолетовый спектра поглощения (зависимость молярного коэффициента поглощения ελ поглощения ээлектромагнитной энергии чистым органическим веществомэнергии бутеном-1 (1) и бутаноном (2)) в УФ-области от длины волны излучения.) Можно ли пПо оси ординат отложен молярный коэффициент поглощения ελ. По виду такой зависимости можно иидентифицировать чистое поглощающее вещество, если оно единственное в пробе?. А если в пробе присутствует смесь веществ? [Фримантл. Химия в действии. Ч.2, с.333.]
Люминесценция подразделяется на флуоресценцию (переизлучение атомов и молекул сразу после возбуждения) и фосфоресценцию (переизлучение только молекул спустя заметное время после возбуждения). [1],с. 39.
Люминесценция.[8], с.306. Свечение вещества, возникающее …после поглощения им энергии возбуждения; представляет собой избыточное излучение по сравнению с тепловым излучением тела при данной температуре. Длительность люминесценции от …10-10 с до … нескольких часов. Люминесценция наблюдается в …УФ,, видимой … и …ИК областях спектра. Кратковременную люминесценцию, затухающую сразу после прекращения ее возбуждения, называют …флуоресценцией; длительную люминесценцию, продолжающуюся некоторое время после ее возбуждения называют … – фосфоресценцией. Источниками возбуждения люминесценциии могутжет быть свет (фотолюминесценция), электрическое поле (электролюминесценция), механическая деформация (триболюминесценция), химические реакции (хемолюминесценция), рентгеновские лучи (рентгенолюминесценция), пучок электронов (катодолюминесценция) и т.п. ….
Резонансная флуоресценция и нерезонансная флуоресценция.– энергия испускаемого (переизлученного) кванта равна энергии поглощенного. Нерезонансная флуоресценция - энергия испускаемого кванта не равна энергии поглощенного.
Люминесцентный анализ. [8], с.306. Совокупность методов анализа, основанных на явлении … люминесценции. Широко применяется анализ, основанный на фотолюминесценции исследуемого вещества, возбуждаемой УФ излучением, источником которого служат …ртутно-кварцевые или ксеноновые лампы и лазеры. Регистрируют люминесценцию …визуально или фотоэлектрически (с помощью спектрофотометра). (как?). Качественный анализ (по спектру люминесценции) используется для обнаружения следов токсичных и канцерогенных веществ. Количественный анализ основан на зависимости интенсивности люминесценции от … количества люминесцирующего вещества.
Фотометрия пламени. Область применения. [3], с.826. Один из видов (эмиссионного, абсорбционного) спектрального анализа. Применяется для количественного определения в растворах щелочных, …щелочноземельных и … редкоземельных элементов по их …спектральным линиям или полосам. Источником возбуждения спектров является …пламя водорода, ацетилена. Анализируемый раствор распыляется в пламя в виде аэрозоля в токе кислорода или воздуха. Наиболее удобно для возбуждения спектра водород-кислородное пламя, имеющее высокую температуру 2900 К и малую интенсивность собственного излучения. Измерение интенсивностей спектральных линий производится ….фотоэлектрическим способом. Фотометрию пламени отличают точность и быстрота анализа, малый предел обнаружения компонентов смеси (для щелочных элементов 0.01 мкг/мл, для щелочноземельных – 0.1 мкг/мл)
Метод добавок. Зачем используется этот метод. [1], с.53.
Энергия частиц или квантов излучения. Размерности.
Мощность потока излучения. Размерность.
Источники ЭМИ.
Основание для выбора спектра испускания или поглощения при анализе. Соотношение интенсивностей линий, отвечающих одному и тому же переходу i ↔ j в спектрах испускания (эмиссии) I е и поглощения (адсорбции) Iа различно и зависит от частоты кванта, соответствующего этому переходу: …. Т
(Iе / Iа) ~ v 3
т.е. с увеличением частоты v интенсивность линии испускания во много раз (больше, меньше)превосходит интенсивностиь линии поглощения. Поэтому спектры испускания исследуют в рентгеновской, УФ и видимой областях (с высокимие, низкими частотамиы). А спектры поглощения удобнее исследовать в …ИК, микроволновой и радиочастотной областях (высокие, низкие частоты). [Золотов, т.2, с.204]
Распределение излучаемой нагретым источником энергии Еλ в зависимости от λ и Т λ и Т (закон Планка). Приведите правдоподобные графики зависимости Еλ от λ и от Т. Закон Вина о длине волны λ max, на которую приходится максимум лучистой энергии: λ max = b / T…. Размерности.
Атомарные и молекулярные спектры.
Методы возбуждения спектров.
Приведите эскиз источника рентгеновского излучения (рентгеновской трубки).Рентгеновская спектроскопия.
Область применения. [8], с.506
Методы рентгеновской спектроскопии применяются для неразрушающего анализа веществ (рентгеновский спектральный анализ). Используется главным образом эмиссионная рентгеновская спектроскопия. Приведите правдоподобный спектр рентгеновского излучения от рентгеновской трубки. Опишите спектр Различают первичное и вторичное рентгеновское излучение. Первичное рентгеновское излучение получают бомбардировкой заряженными частицами исследуемого образца, служащего мишенью в рентгеновской трубке. Вторичное (флуоресцентное) рентгеновское излучение получают облучением электромагнитным излучением исследуемого образца. Различают также тормозногое и характеристическогое рентгеновскогое излученияе. В первичном рентгеновском излучении выделяют тормозное и характеристическое излучения. Тормозное излучение обусловлено рассеянием заряженных частиц на атомах, характеристическое рентгеновское излучение – ионизацией атома с выбрасыванием электрона одной из внутренних оболочек. Спектр тормозного излучения сплошной, характеристического - линейчатый. Возбуждение первичного характеристического излучения осуществляется пучком электронов с энергией 10 – 100 кэВ или (1.6 – 16) ∙10-15 Дж, флуоресцентного – рентгеновским излучением и γ - излучением. Соответственно различают рентгеноспектральный анализ и рентгеновский флуоресцентный анализ. Прибор для рентгеновского флуоресцентного анализа состоит из рентгеновской трубки, дифракционной решетки и детектора – счетчика ионизирующего излучения.
Качественный рентгеновский флуоресцентный анализ основан на …линейной зависимости квадратичного корня из частоты характеристического рентгеновского излучения от атомного номера элемента (закон Мозли), количественный – на …связи между интенсивностью I этого излучения с числом излучающих атомов.
Рентгеновский флуоресцентный анализ применяется для определения ….всех элементов периодической системы, начиная с Na, в растворах и в твердых объектах (пределы обнаружения 10-3 -10-4%).
Рентгеновское излучение (λ от 10-12 до 10-8 м, ν от 1020 до 1016 Гц). [5], с.221. При попадании на исследуемый образец (мишень) пучка ускоренных электронов основная их масса замедляется (теряет энергию) за счет многократных взаимодействий с электронами атомов мишени. Энергия, теряемая электронами, превращается в энергию рентгеновского излучения с непрерывным спектром, которое называется тормозным излучением. Непрерывный спектр рентгеновского излучения имеет четкую нижнюю длину волны λ мин (или максимальную частоту), соответствующую максимальной энергии электронов в исходном пучке. По мере увеличения ускоряющего напряжения энергия электронов в пучке увеличивается и достигает величины, достаточной для полного выбивания наиболее сильно связанных с ядрами атомов мишени ближайших к ним К -электронов. А на их место переходят электроны с L -оболочек и испускаются фотоны рентгеновского излучения с длиной волны, соответствующей разности энергий К и L -оболочек данного элемента. Состояние электронов внутренних оболочек не зависит от химического состояния атома, поэтому характеристики рентгеновского излучения практически не зависят от химического или физического состояния атома. Длины волн, соответствующие таким высоким энергиям малы, порядка 0.001-1 нм. Спектр рентгеновского излучения вещества мишени, облученной электронами высоких энергий, имеет вид, приведенный на рисунке, где на сплошной спектр накладываются отдельные линии. Эти линии будут разными для атомов разных элементов. Линии излучения, соответствующие переходу между L- и К –оболочками, обозначаются К α; рентгеновское излучение, возникающее благодаря переходам между М - и К -оболочками, обозначается К β и т.д. Измерение длин волн или энергий дает возможность определять различные элементы в образце. Измерение излучаемой мощности для характеристических частот используется для количественного определения компонентов пробы.

Рис. Рентгеновский спектр испускания трубки с мишенью (анодом) из молибдена 42Мо, работающей при ускоряющем напряжении 35 кВ. Фон со сплошным спектром обусловлен тормозным излучением. На рисунке пики характеристического излучения соответствуют К α (62 пм) и К β (70 пм) – электронным переходам. Нижняя граница λ мин сплошного спектра составляет 35 пм, что соответствует ускоряющему напряжению 35 кВ. 1 пм = 10-12 м. [Юинг], с.222.
Источник рентгеновского излучения. Закон Мозли. позволяет вычислить частоты пиков характеристического излучения для разных элементов: корень квадратный из частоты ν характеристического рентгеновского излучения элемента и его атомный номер Z связаны линейной зависимостью

где R – постоянная Ридберга; S n – постоянная экранирования, учитывающая влияние на отдельный электрон всех остальных электронов атома; n - главное квантовое число.
Изобразите график зависимости 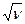 от Z при разных n.
от Z при разных n.
Характеристические линии и линии отпечатков пальцев. Это атомный или молекулярный спектр?Поясните. В какой области частотспектра? Атомный или молекулярный спектр?
ИК - спектроскопия. Область характеристических полос и область «отпечатков пальцев».
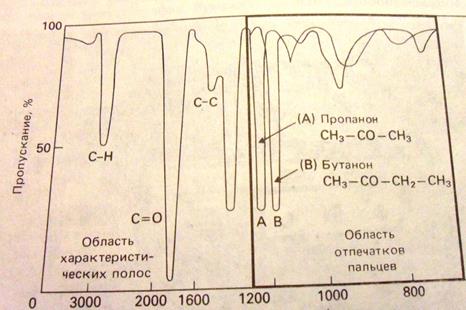
3000 1200 800 ← u, см-1
9 ∙1013 3.6∙1013 2.4∙1013 ← n, Гц
3.3 8.3 12.5 → l, мкм
Рис. Инфракрасный (ИК) спектр поглощения пропанона СН3 – СО - СН3 и бутанона
СН3 – СО - СН2 - СН3. Слева расположен участок спектра, называемый характеристическим. По характеристическому спектру можно определить наличие в молекулах пропанона и бутанона определенных функциональных групп: ≡СН, =С=О, ≡С-С≡. Этот участок спектра одинаков и для пропанона и для бутанона. Справа расположен участок спектра, называемый областью отпечатков пальцев. Спектры поглощения пропанона и бутанона здесь различны. По спектрам в области отпечатков пальцев можно точно идентифицировать анализируемое вещество. По оси абсцисс отложены волновые числа u. Для удобства ниже шкалы волновых чисел u расположены шкалы частот n и длин волн l. [Фримантл. Химия в действии. Ч.2,], с.333.
Характеристические частоты (характеризуют что?). Это одинаковые или мало отличающиеся друг от друга частоты колебаний определенных …групп атомов в различных молекулах. Эти частоты соответствуют определенным химическим связям, (например, … ≡С - Н, ≡С - С≡, =С = С=, ≡С - Cl, =С=О и др.)
.
Монохроматоры ЭМИ. Монохроматор (призма, дифракционная решетка) – прибор, выделяющий узкую полосу длин волн из широкой части спектра. В призмах угол преломления падающего на нее света зависит от длины волны. В дифракционной решетке лучи, отраженные от различных штрихов решетки, интерферируют. В обоих случаях световые лучи с разными длинами волн наблюдаются под разными углами. [Золотов], с.217.
Оптическая плотность D = lg(I o/ I).
Пропускание T = I / I o.
Закон поглощения электромагнитного излучения (закон Бугера-Ламберта-Бера): …, где ….
I = I o exp(- k*∙ l) = I o 10- k ∙ l = I o 10- ε∙c∙l
где k*= 2.3 k, In10 = 2.3.
Вывод зависимости. ε – молярный коэффициент поглощения, c – молярная концентрация, l - длина пути в поглощающей среде.
Основной закон светопоглощения (Закон Бугера-Ламберта-Бэра). [1], с.43.

Закон аддитивности оптических плотностей. Оптическая плотность смеси веществ, подчиняющихся основному закону поглощения света и не вступающих в химические реакции друг с другом, равна сумме парциальных оптических плотностей, характеризующих поглощение каждого вещества в отдельности:
D λ = Σ D λ i = l∙ Σ k λi ∙ ci,
где D λ – оптическая плотность смеси веществ; D λ i = k λ i ∙ l∙ ci – парциальная оптическая плотность i -го вещества; k λ i и сi – коэффициент поглощения и концентрация i -гo вещества. Поясните использование этого закона на примере анализа спектра смеси двух веществ с целью определения их концентраций. [Юинг], с.86 и [2].
Зависимости оптической плотности D от концентрации c поглощающих частиц при 1) подчинении закону Бера, 2) при положительном отклонении от закона, 3) при отрицательном отклонении. Причины отклонения. разделяют на инструментальные и химические. Немонохроматичность излучения приводит к отрицательным отклонениям от основного закона поглощения света – это инструментальная причина. Химические причины обусловлены изменением числа поглощающих частиц вещества вследствие протекающих в растворе реакций протонирования, окисления - восстановления, комплексо - и осадкообразования. Вызванные химическими причинами отклонения могут быть положительными и отрицательными.
Спектры ИК. Колебательные спектры регистрируют в форме инфракрасного спектра поглощения (ИК-спектров) или эмиссионных спектров комбинационного рассеяния (спектров КР или, то же самое, рамановских спектров). ИК-спектр представляет собой спектр поглощения в инфракрасной области.
Спектры комбинационного рассеяния (КР).[Золотов, т.2,], с.295. Спектр КР возникает при облучении вещества монохроматическим светом УФ или видимого диапазона. Под воздействием монохроматического светового потока с частотой v на молекулы вещества, они поляризуются и рассеивают падающий на них свет. Рассеянный свет с неизмененной частотой v называют релеевским рассеянием. Одновременно в рассеянном свете присутствуют и кванты с измененными частотами v ± v oi (комбинационное рассеяние), где v oi – частота нормальных колебаний атомов в молекуле. Т.о. колебательные частоты наблюдаются в виде комбинационных смещений частоты возбуждающего света v в УФ или видимой области спектра. Частоты v - v oi называют стоксовыми, а частоты v + v oi - антистоксовыми.

Приведите пример спектра комбинационного рассеяния. Охарактеризуйте его. Как по этому спектру можно определить энергии взаимных колебаний атомов?
Рис. Спектр комбинационного рассеяния жидкого СCI4, полученный при возбуждении СCI4 Не-Nе лазером при 632.8 нм. Большой пик ∆ 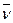 = 0 связан с релеевским рассеянием. Как видно из рисунка, частоты ≈200, ≈300 и ≈450 см-1 соответствуют частотам взаимных колебаний атомов С и СI в молекуле СCI4. [Юинг], с.168.[Золотов], с.297.
= 0 связан с релеевским рассеянием. Как видно из рисунка, частоты ≈200, ≈300 и ≈450 см-1 соответствуют частотам взаимных колебаний атомов С и СI в молекуле СCI4. [Юинг], с.168.[Золотов], с.297.
Схема двухлучевого спектрофотометра (с выходной щелью).
Спектрограф-прибор, сходный с спектрофотометром, но без выходной щели. На ее месте ставят фотопластинку. В спектрофотометре вместо фотографической пластинки располагают фотоэлектрический детектор.
Классификация спектров. Спектры испускания (эмиссионный), …поглощения (абсорбции), …рассеяния, отражения. Спектры: атомные, …молекулярные. Спектры: рентгеновский, ….оптический (УФ, …видимый, ИК), ….радиочастотный (СВЧ, короткие, средние, длинные волны). Спектры: электронный, …колебательный, … вращательный. Спектры непрерывные, …линейчатые, … полосатые.
Спектр …линейчатый (спектр независимых атомов), …полосатый (спектр независимых молекул), …сплошной (спектр нагретых твердых тел).
Источники возбуждения эмиссионных спектров: свет (фото), …электрическое поле, …механическая деформация, …химическая реакция, …рентген, …поток электронов.
Оптический диапазон спектра ЭМИ включает: … УФ,, …видимую, … облаИК - области спектра. [1], с. 40.
УФ-область спектра подразделяется на дальнюю (вакуумную) и ближнюю. [1],с. 40. Вакуумная часть УФ-области солнечного света полностью поглощается атмосферой Земли. Ближняя – поглощается частично.
ИК-диапазон спектра подразделяется на ближнюю (к области видимого света), среднюю и дальнюю области. [1], с. 40.
Методы спектрального анализа: рентгеновская спектрометрия, …оптическая, … радиочастотная (ЭПР, ЯМР). [1], с.38.
Энергетические состояния атома, молекулы: основное с минимальной энергией, возбужденное (с переходом электронов с основных на возбужденные уровни). [1], с.38.
Резонансные спектральные линии. Возникают при переходе атома или молекулы …в основное состояние из возбужденного, или из основного состояния в возбужденное. [1], с.38..
Спектры испускания: эмиссионные, люминесцентные. Возбуждение спектров: γ-излучением, рентгеном, видимым светом, потоками заряженных микрочастиц.
Связь частоты и длины волны излучения с энергией перехода: …,
где …. 
где h = 6.626 ∙10-34 Дж∙ с (постоянная Планка); ν – частота излучения, 1/с.
Масс-спектрометр - прибор для разделения ионизированных молекул и атомов по их массам, основанный на воздействии магнитного или электрического поля на пучки ионов, летящих в вакууме. В масспектрометрах регистрация ионов осуществляется электрическими методами (сила тока), в масспектрографах – по потемнению фоточувствительного слоя. Изобразите схему масс-спектрометра. Приведите пример масс-спектра. Что отложено по осям координат?Схема прибора. Пример масс-спектра.

Рис. Схема масс-спектрометра. 1 – буферный резервуар, 2 – ионизационная камера, в которой поток молекул или атомов анализируемой пробы ионизируется с помозью потока ускоренных электронов, 3 – впуск образца, 4 – электронная пушка (источник потока укоренных электронов), 5 – отрицательно заряженные пластины, с помощью которых ускоряется поток положительно заряженных ионов пробы, 6 – магнитное поле, 7 – траектория ионов с меньшей массой, 8 – траектория ионов с большей массой, 9 – к вакуумному насосу для создания вакуума на пути движения ионов, 10 – усилитель тока, 11 – устройство для записи силы тока в пике.
Хроматография
Изотерма адсорбции. В раствор с примесью вещества Х (или в газовую смесь с примесью Х) поместили зерна адсорбента. Начинается адсорбция вещества Х на поверхности зерен. Адсорбция продолжается до наступления равновесия между оставшимся веществом Х в растворе и веществом Х на поверхности адсорбента. Изотерма адсорбции показывает связь между …равновесными концентрациями вещества Х в растворе (газе) и в адсорбенте при данной температуре. Неполярные вещества адсорбируются преимущественно на неполярных адсорбентах. Например, хлороформ на угле. И наоборот. Например, пары воды адсорбируются на силикагеле, порошке оксида алюминия и др.
Изотерма абсорбции. пПоказывает связь между ….равновесными концентрациями вещества Х в газовой фазе и в растворе, граничащем с газом (при данной температуре).
Хроматография. Приведите кКлассификациюя методов хроматографии по признакам: агрегатное состояние подвижной и неподвижной фаз, природа элементарного акта (адсорбция, абсорбция, экстракция, ионный обмен), аппаратурное оформление процесса. (колоночная, капиллярная, плоскослойная). С.64.
Хроматография. Приведите бБлок-схемуа типичного газового хроматографа. с.67. 1- баллон с газом (элюэнтом) под высоким давлением; 2- устройство для ввода пробы; 3- хроматографическая колонка; 4- термостат; 5- детектор и регистратор хроматограммы.
Хроматография. Приведите бБлок-схемуа типичного жидкостного хроматографа. 1- резервуар для жидкости (элюэнта). 2- насос высокого давления для подачи жидкости (50-100 атм); 3- устройство для ввода пробы; 4- хроматографическая колонка; 5- термостат; 6- детектор и регистратор хроматограммы. [Харитонов.], с. 433.
Хроматографическая колонка. представляет собой Это основной конструктивный элемент хроматографа – трубкуа, заполненнуюая … неподвижной фазой, по которой во время выполнения анализа движется подвижная фаза с исследуемой пробой. В колонке происходит разделение компонентов исследуемой смеси. Что означает «разделение компонентов»?
Хроматографическая колонка характеризуется 1) эффективностью, 2) …селективностью, 3) … емкостью.
Эффективность хроматографической колонки является мерой расширения …пика компонента пробы при его движении вдоль колонки и тесно связана с числом эффективных теоретических тарелок-воображаемых участков по длине колонки., на каждом из которых как бы достигается равновесное распределение конкретного компонента пробы между подвижной и неподвижной фазами. Кроме того, на нее влияют такие факторы, как вихревая (конвективная) диффузия, продольная молекулярная диффузия и сопротивление массопереносу. ЧКак правило, число теоретических тарелок в современных капиллярных колонках очень велико - достигает ….
нескольких тысяч. Это позволяет при правильном подборе селективности неподвижной фазы разделять все компоненты любой, даже самой сложной смеси.
Селективность хроматографической колонки определяется как …разница в степени удерживания разных компонентов смеси на неподвижной фазе. Обычно ее выражают отношением …приведенных времен удерживания пары критически важных компонентов пробы. Если это отношение не равно 1, то пто пики (можно, невозможно)могут быть разделитьены.. Селективность колонки зависит от характера взаимодействия определяемого вещества и неподвижной фазы. Эти взаимодействия могут быть как неполярными дисперсионными (силы Ван-дер-Ваальса), так и полярными специфическими (обычно диполи и водородные связи).
Емкость хроматографической колонки это ….колонки связана с ее физическими размерами и определяет максимальный объем пробы, который можно ввести в колонку без ее «перегрузки», т.е. без отклонения пиков от гауссовской формы. Соответственно, емкость набивных колонок значительно больше, чем капиллярных.
Набивными колонками в газовой хроматографии называют колонки большого диаметра (до 2 мм), которые можно изготовить самостоятельно, заполняя их заранее приготовленным адсорбентом (…трепелом, …толченым кирпичем и т.п.).
Капиллярные колонки изготавливают из капилляров (диаметром до …0.1 мм). Чем меньше диаметр колонки, тем (меньше, больше) размытие пиков в результате диффузии и, соответственно, тем (лучше, хуже) еевыше их эффективность.
Это позволяет снизить время анализа и улучшить разделение компонентов. Кривая Ван-Деемтера для колонок малого диаметра тоже более благоприятна и позволяет варьировать скорость газа-носителя в более широких пределах без катастрофической потери эффективности.
Детекторы хроматографа – устройство, которое способное реагировать на …изменение концентрации определяемого вещества в элюэнте. Наиболее часто используется детектор по теплопроводности. Принцип его действия заключается в изменении …температуры нагретой нити при обдувании ее газом (элюэнтом с компонентом смеси) с разной теплопроводностью. Электронозахватный детектор. Если в газе, проходящем мимо радиоактивного источника, оказываются молекулы, склонные к ионизации, то возникает …пропорциональный их концентрации ток, который можно измерить.
Хроматография. Изобразите типичную Внешний вид хроматограммуы. ВыделитеВыделяемые параметры хроматограммы (время удерживания, высотуа и ширинуа пиков). Структура времени удерживания: t R = t m + t s , где …. Анализ хроматограммы.
Хроматография. Поясните, как определяется сСтепень разделения компонентов анализируемой смеси (пиков) по хроматограмме.
Хроматография. Мертвое время t m и свободный (мертвый) объем … t m∙ u хроматографической колонки. (где u – объемная скорость элюэнта).
Хроматография. Время удерживания t R и приведенное время удерживания … t R*= t R - t m . Для чего используется эта величина?
Хроматография. Принципы качественного и количественного определения компонентов смеси по хроматограмме. [1], с.65.
Хроматография. Для описания процессов, протекающих в хроматографической колонке, используют два подхода: 1) теорию …теоретических тарелок и 2) теорию …удерживания (хроматографической подвижности). [1], с.56.
Хроматография. Теория теоретических тарелок для компонента смеси. С.57.
Хроматография. Расчет высоты Н эквивалентной теоретической тарелки (ВЭТТ) и числа n теоретических тарелок по хроматограмме. [1], с. 63.

 , где ….
, где ….
Хроматография. Уравнение Джеймса и Мартина:

Хроматография. Теория удерживания (хроматографическая подвижность).
Хроматография. Функция Ван-Деемтера и ее график в координатах Н и u. Анализ этой функции. Ее использование для нахождения оптимальной скорости u течения элюэнта через колонку, при которой высота эквивалентной теоретической тарелки для данного компонента анализируемой смеси становится минимальной. [1], с.57.
Ядерно-физические методы химического анализа.
Параметры, характеризующие радиоактивный изотоп: массовое число, заряд ядра, вид распада, период полураспада. Связь периода полураспада с постоянной распада. (Все на примере радиоактивного изотопа углерода  ). [2]
). [2]
Нейтронно-активационный анализ (используется в основном для выявления …примесей в чистых веществах). Принцип. Пример реакции получения радиоактивного изотопа 28AI в результате нейтронной активации стабильного изотопа. 27AI + 1n = 28AI. [2]
Детекторы ионизирующей радиации: 1) …фотографические, 2) …сцинтилляционные счетчики, 3) г…азовые ионизационные детекторы (счетчик Гейгера). Поясняющие схемы. [2]
Измерение нейтронных потоков. 10B(n,?α)7Li. [2]
Метод изотопного разбавления. Область применения.
[2] Например, для определения доли выделенного из смеси чистого вещества.
Ядерный магнитный резонанс (ЯМР).Принцип и пример спектра. Метод ЯМР основан на явлении магнитного резонанса (избирательном поглощении электромагнитного излучения анализируемым веществом в радиочастотном диапазоне) и обусловлен магнитными свойствами атомных ядер этого вещества.Используется в основном для анализа структуры органических соединений, содержащих водород (ядра водорода).[Золотов], с. 339.

Рис. Характеристический спектр ядерного магнитного резонанса этанола СН3СН2ОН. По оси ординат отложена интенсивность поглощения энергии радиочастотного диапазона ядрами водорода, по оси абсцисс - длина волны излучения. В молекуле этанола есть атомы водорода трех типов: 1) входящие в метильную группу –СН3, 2) входящие в метиленовую группу –СН2-, 3) входящие в гидроксильную группу –ОН. Протоны атомов водорода каждого из этих типов имеют различные резонансные частоты. Т.о. характеристический спектр этанола состоит из трех отдельных пиков. В качестве стандарта, относительно которого ведется отсчет резонансных часто, обычно используется пик поглощения протонов в молекулах тетраметилсилана (СН3)4Si (ТМС) (маленький пик справа). Протоны в молекулах ТМС очень хорошо экранированы от внешнего магнитного поля окружающими электронами, поэтому резонансный пик протонов ТМС соответствует довольно низкой частоте (большой длине волны). В других молекулах (и в этаноле) протоны экранированы меньше и потому их резонансные частоты больше. Эти протоны считаются деэкранированными. [Фримантл], с.335.

Рис. Схема простейшего прибора для снятия спектра ЯМР.[]
Электронный парамагнитный резонанс (ЭПР). Сущность явления состоит в том, что в постоянном магнитном поле вектор спина электрона может ориентироваться двояко (ms = +1/2 и ms = -1/2) и соответственно возможны два энергетических состояния - нижнее с энергией E1 (ms= -1/2) и верхнее с энергией E2 (ms = +1/2). Расстояние между этими двумя уровнями D E = E2 - E1 пропорционально напряженности магнитного поля H:
D E = gS∙mB∙H,
где gS - фактор спектроскопического расщепления, mB - магнетон Бора.
Для перевода электрона из нижнего состояния в верхнее ему нужно сообщить энергию D E, например, воздействуя радиочастотным электромагнитным полем постоянной частоты. Изменяя величину напряженности магнитного поля Н, можно добиться, чтобы энергия радиочастотного излучения hn совпала по величине с D E. При этом наблюдается резонансное поглощение энергии излучения
hn = gS∙mB ∙H.
На этом явлении и основан метод ЭПР: при постоянной частоте электромагнитного излучения и медленном изменении внешнего магнитного поля регистрируется изменение поглощаемой в образце мощности. В спектрометрах ЭПР автоматически регистрируется интенсивность излучения как функция напряженности магнитного поля. Обычно в спектрометрах ЭПР при напряженности Н = 3200 Э (эрстед) явление резонанса наблюдается при частоте излучения n ~ 9000 МГц (l ~ 3 см), т.е. в радиочастотной области (радиоспектроскопия).
Методом ЭПР исследуют молекулы, атомы и радикалы в газовой среде, растворах и различных типах матриц. ЭПР - один из наиболее чувствительных методов обнаружения и идентификации свободных радикалов, установления их электронной конфигурации и геометрии. Метод применяется для исследования комплексных соединений, в частности соединений переходных и редкоземельных металлов.
| <== предыдущая лекция | | | следующая лекция ==> |
| Изучение профессиональных намерений старшеклассников | | |
Не нашли, что искали? Воспользуйтесь поиском: