
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Шпателя, стеклянные палочки.
3. Ход работы
Навеску образца (mo), которая содержит около 0,1 г железа, растворяют при нагревании с 20 мл концентрированной хлористоводородной кислотой. Если растворение неполное, добавляют по каплям перекись водорода. Добавляют 20 мл дистиллированной воды, кипятят в течение 3‑5 мин, охлаждают и добавляют дистиллированную воду до объема около 50 мл.
Раствор пропускают через редуктор со скоростью 2 мл/мин, редуктор промывают 10-15 мл раствора НCl (с = 1 моль/л). Растворы объединяют, переводят в электрохимическую ячейку и титруют раствором бихромата калия, регистрируя объем титранта и э.д.с. Первую пробу образца титруют грубо, порциями титранта по 1 мл. Перед второй, повторной пробой рассчитывают ориентировочное значение объема титранта, чтобы потом, титруя, в пределах скачка потенциала добавлять титрант порциями по 2-3 капли. После скачка продолжают титровать до избытка титранта в 15-20 %. Схему прибора и конструкцию редуктора приведены на рис. 3.3.
4. Обработка результатов
Используя экспериментальные данные зависимости ЭДС от объема титранта, строят кривую титрования, общий вид которой приведен на рис. 3.4. Ион дихромата - в равновесии с ионом гидрохромата,
Cr2O72‑ + H2O D 2 HCrO4‑, lg K = 1,53 [I = 0], 1,97 [1,0], 2,17[3,0].
До точки стехиометрии концентрация [Cr2O72‑] мизерная в сравнении с [HCrO4‑]. Учитывая, что окислителем является преимущественно мономер HCrO4‑, в полуреакции восстановления которого участвует (только) 3 электрона, рассчитывают потенциал в стехиометрической точке (ЕS) и соответствующий обьем титранта (vS), ЕS = (3 Е 1 + Е2) / (3 + 1).
Массовую долю железа в образце рассчитывают по уравнению:
w = vS× с (K2Cr2O7)× M (Fe)/mo
где M (Fe) = 55,847 г/моль – молярная масса железа.
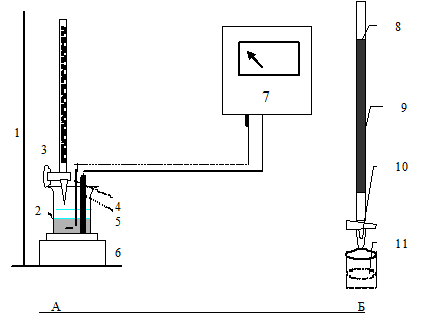
 Рис.3.3.
Рис.3.3.
А – прибор для потенциометрического титрования, Б – Редуктор.1 – штатив, 2 – ячейка для титрования, 3 – бюретка, 4 – платиновый электрод, 5 – электрод сравнения, 6 – магнитная мешалка, 7 – иономер, 8 – стеклянная трубка, частично заполнена гранулами металлического кадмия, 9 – гранулы металлического кадмия, 10 – устройство, регулирующее скорость истечения раствора, 11 – раствор восстановленного компонента.
Литература
1. Кольтгоф И. М., Сендел Е. Б. Количественный анализ – М.: Л., Госхимиздат, 1948. – 824 с.
2. Лайтинен Г.А. Химический анализ. Пер. с англ. – М.: Химия, 1966. – 656 с.
3. Шарло Г.. Методы аналитичесой химии. – М.: Л., Химия, 1965 – 976 с.
4. Умланд Ф., Янсен А., Тириг Д., Вюнш Г. Комплексныесоединения в аналитическойхимии – М.: Мир, 1975. – 532 с.
5. Шварценбах Г., Флашка Г. Комплексонометрическое титрование – М.: Химия, 1970. – 360 с.
Не нашли, что искали? Воспользуйтесь поиском: