
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Протона, нейтрона и электрона
| Частица | Обозна-чения | Заряд | Масса покоя | ||
| Кл | относи- тельный | кг | относи-тельная а.е.м. | ||
| Протон | p, 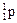
| +1,6 · 10–19 | +1 | 1,673 · 10–27 | 1,0073 |
| Нейтрон | n, 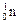
| 1,675 · 10–27 | 1,0087 | ||
| Электрон | е, е–, 
| –1,6 · 10–19 | –1 | 9,109 · 10–31 | 0,0005 |
Поскольку в электрически нейтральном атоме число электронов равно числу протонов, с помощью периодической системы химических элементов можно легко определить число протонов, нейтронов и электронов в атоме любого химического элемента.
Например, натрий в периодической системе химических элементов имеет порядковый номер 11 и атомную массу 22,99 (~23) а.е.м. Следовательно, ядра большинства электрически нейтральных атомов натрия состоят из 11 протонов и 12 нейтронов (23 – 11 = 12), и вокруг них движутся 11 электронов.
Вид (совокупность [24] ) атомов с определённым значением заряда ядра Z (числом протонов в ядрах) называется химическим элементом [25].
В атомах одного и того же химического элемента может содержаться разное число нейтронов. Такие атомы при одинаковом числе протонов имеют разное массовое число и, следовательно, разную массу.
Вид атомов с определёнными значениями заряда Z (числом протонов в ядрах) и массового числа A называется нуклидом или вид атомов данного химического элемента с определённым значением массового числа называется нуклидом.
Нуклид обозначают символом соответствующего химического элемента с указанием массового числа его атомов – А Э или атомного номера подстрочным и массового числа надстрочным индексами –  Э, например,
Э, например,  С. Другая форма записи нуклида – название химического элемента с указанием массового числа его атомов, например углерод-12.
С. Другая форма записи нуклида – название химического элемента с указанием массового числа его атомов, например углерод-12.
Нуклиды с разным массовым числом, а, следовательно, с разным числом нейтронов, называются изотопами [26].
В природе существуют стабильные и нестабильные (радиоактивные) нуклиды. В настоящее время известно более 300 стабильных нуклидов. Искусственные радиоактивные нуклиды получают в результате ядерных реакций.
Количество нуклидов всех известных химических элементов превышает 2 600. Максимальное число стабильных изотопных нуклидов у олова – двенадцать – с массовыми числами от 112 до 124. Есть и элементы-одиночки, представленные всего одним нуклидом, – это Be, F, Na, Al, P и др.
Таким образом, изотопы – это семейство нуклидов химического элемента, например, водорода: 1Н (обычный водород, или протий), 2H (D – дейтерий), 3Н (Т – тритий). Водород является единственным химическим элементом, нуклиды которого имеют собственные названия и даже символы. Тритий, который можно получить только искусственным путём, радиоактивен. Искусственным путём получены также сверхтяжёлые нуклиды водорода: 4Н, 5Н, 6Н.
Относительная атомная масса, или просто атомная масса, химического элемента (Аотн., или Ar[27]) равна среднему арифметическому масс атомов нуклидов элемента с учётом их молярной доли в природе (распространённости).
Ar (Э) = ΣAi · xi, xi = ni/n,
где Ai – массовое число данного нуклида;
xi – молярная доля данного нуклида в природной смеси;
ni – число атомов данного нуклида;
n – суммарное число атомов всех нуклидов.
Например, природный хлор состоит из двух нуклидов: 35С1 и 37Cl, массы которых соответственно равны 34,964 и 36,961 а.е.м., а относительные распространённости составляют 75,53 и 24,47 %. Относительная атомная масса хлора[28] равна:
(34,964 · 75,43 + 36,961 · 24,47) / 100 = 35,453 а.е.м.
Атомная масса является одной из основных характеристик химического элемента.
При химическом взаимодействии атомов их ядра остаются без изменения, а строение внешних электронных оболочек изменяется вследствие перераспределения электронов между ними. Способность атома химического элемента отдавать или присоединять электроны, зависящая от заряда его ядра, строения электронной оболочки и радиуса, определяет его химические свойства.
Электронная оболочка атома – это пространство вокруг ядра, в котором находятся принадлежащие ему электроны.
Электроны атома с примерно равной энергией образуют электронный слой (электронную оболочку или энергетический уровень).
Энергетические уровни атома нумеруются по возрастанию энергии, а электронные слои – по удалённости от ядра, и обозначаются буквами: первый уровень (слой) – К, второй – L, третий – М, четвёртый – N и т. д. На основании более тонких различий в энергии электронов уровни подразделяются на подуровни (подслои, или подоболочки).
Расстояние от ядра до наиболее удалённого электрона определяет размер атома, который составляет весьма малую величину – порядка 100 пм в поперечнике. Диаметр атомного ядра, если считать его шарообразным, – порядка 10–2-10–3 пм, то есть ядро в 10-100 тысяч раз меньше самого атома и занимает примерно 1/1015 часть его объёма (рис. 12).

Рис. 12. Соотношение размеров ядра и электронной оболочки атома
Атомы нельзя увидеть ни в один оптический микроскоп. По своим размерам они во столько раз меньше обыкновенного яблока, во сколько раз яблоко меньше земного шара.
Если для наглядности представить атомное ядро увеличенным до 1 мм, то атом в этом случае увеличится до 100 м (размер футбольного поля 90 × 120 м). В то же время вся масса атома фактически сосредоточена в его ядре. Если бы можно было собрать 1 см3 атомных ядер, то их масса оказалась бы равной приблизительно 114 млн. т! Трудно даже представить себе, насколько огромна плотность ядерного вещества, так как она чрезвычайно велика по сравнению с плотностью обычных веществ и составляет около 1014 г/см3.
Не нашли, что искали? Воспользуйтесь поиском: