
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ЯКІСНИЙ АНАЛІЗ НЕОРГАНІЧНИХ КАТІОНІВ
Існують сірководнева, кислотно-основна та аміачно-фосфатна класифікації катіонів. Історичним перший виник сірководневий систематичний хід аналізу катіонів, що запропонований російським хіміком в 1871 році Меншуткіним. В основі якого лежить різна розчинність сульфідів металів в залежності від кислотності середовища. Основним недоліком цієї класифікації є токсичність сірчистого водню. За аміачно-фосфатною класифікацією катіони поділяються на 5 груп, наведених в таблиці 1.
Катіони першої аналітичної групи K+ Na+ NH4+
До першої аналітичної групи відносять катіони головної підгрупи періодичної системи елементів Li+, Na+, K+, Rb+, Cs+, а також комплексний аніон NH4+. Катіони першої аналітичної групи утворюють сполуки з іонним характером зв’язку. Майже всі сполуки катіонів першої групи розчинні у воді, тому вони не мають групового реагента. Іони K+ та Na+ стійкі до дії окисників та відновників, здатні утворювати пересичені розчини. Усі іони безбарвні, окрім сполук, до складу яких входить забарвлений аніон.
Таблиця 1
| Група | Катіони | Груповий реагент | Розчинність сполук |
| I | K+ Na+ NH4+ | Немає | Хлориди, нітрати, фосфати розчинні у воді |
| II | Перша підгрупа Ва2+, Sr2+, Ca2+, Mg2+, Mn2+, Fe2+ Друга підгрупа Fe3+, Аl3+, Cr3+, Bi3+ | (NH4)2HPO4 +NH4OH | Фосфати Ва3(PO4)2, Sr3(PO4)2, Ca3(PO4)2, Fe3(PO4)2, Mg(NH4)PO4, Mn(NH4)PO4 нерозчинні у воді, але розчинні у оцтовій кислоті. Фосфати АlPO4, CrPO4, FePO4, BiPO4 нерозчинні у воді, оцтовій кислоті, але розчинні в хлоридній, нітратній та сульфітній кислотах |
| III | Cu2+, Cdd+, Hg2+, Co2+, Ni2+, Zn 2+ | (NH4)2HPO4 +NH4OH | Фосфати нерозчинні у воді, але розчинні в надлишку аміаку, з утворенням аміакатів металів [Cu(NH3)4]2+, [Cd(NH3)4]2+, [Hg(NH3)4]2+, [Zn(NH3)4]2+, [Co(NH3)6]2+ , [Ni(NH3)6]2+ |
| IV | Sn2+, Sn(IV), Sb(III), Sb(V), As(III), As(V) | HNO3+ H3PO4 | Метасурм’яна, метаолов’яна, миш’яковисто-фосфорна кислоти не розчиняться у воді та нітратній кислоті |
| V | Ag+, Pb2+, Hg2+ | HCl | Хлориди AgCl, PbCl2, Hg2Cl2 не розчинні у воді та розведених кислотах |
Реакції іонів калію К+
Натрій гідротартрат NaHC4H4O6:
 |
Катіони калію з натрій гідротартратом утворюють білий кристалічний осад калій гідротартрату, який розчиняється в мінеральних кислотах і лугах І не розчиняється в оцтовій кислоті:



Для утворення осаду КНС4Н4О6 можна використовувати і тартратну кислоту:

Але оскільки КНС4Н4О6 розчиняється в сильних кислотах, то ця реакція оборотна і осад з розведених розчинів може не випасти. Для зміщення рівноваги в правий бік необхідно зв’язати іони водню, що досягається введенням ацетат іону:

Оцтова кислота (КНАс=1,86  ) слабкіша за тартратну (
) слабкіша за тартратну (
 ), тому вона не розчиняє КНС4Н4О6.
), тому вона не розчиняє КНС4Н4О6.
Калій гідротартрат помітно розчиняється в холодній воді, тому при проведенні цієї реакції необхідна досить висока концентрація реагуючих речовин.
Розчинність калій гідротартрату значно підвищується при нагріванні. Тому реакцію необхідно виконувати при кімнатній температурі або навіть і при охолодженні. Розчинність КНС4Н4О6 значно зменшується в присутностіетанолу.
Виходячи з наведених властивостей калій гідротартрату, при виявленні іонів К+ за допомогою NaHC4H4O6 слід додержуватися наступних умов:
а) середовище розчину, в якому виявляють iони К+ повинно бути нейтральним або оцтовокислим;
б) концентрація іонів калію повинна бути досить високою;
в) реакцію слід проводити в холодному розчині.
Умови виконання реакції. До 3-5 крапель розчину добавляють 3-4 краплі розчину МаНС4Н4Об. Пробірку струшують і потирають внутрішні стінки скляною паличкою. У присутності К+ випадає осад білого кольору.
Осад КНС4Н4О6 взмучують і піпеткою переносять в чотири пробірки. Досліджують відношення осаду до дії мінеральної кислоти, лугу, оцтової кислоти та нагрівання.
Натрій гексанітрокобальтат (III) Na3[Co(NO2)6] Натрій гексанітрокобальтат (Ш) у нейтральному або оцтовокислому розчині утворює з іонами калію жовтий кристалічний осад;

В лужному середовищі  розкладається з утворенням темно-бурого осаду Со(ОН)3:
розкладається з утворенням темно-бурого осаду Со(ОН)3:
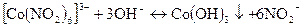
Мінеральні кислоти також розкладають гексанітрокобальтат-іони і тому при виявленні іонів К+ необхідно зв’язувати іони водню додаванням ацетат-iонів:




Реакція виявлення іонів К+ за допомогою Nа3[Со(NО2)6] більш чутлива, ніж реакція з КНС4Н4Об, i тому її використовують частіше.
При зберіганні Nа3[Со(NО2)6] розкладається, причому його буре забарвлення змінюється на рожеве, яке обумовлене забарвленням іону Со2+. Такий реактив непридатний для виявлення Іонів К+.
Іони NН4+ утворюють з Nа3[Со(NО2)6] осад, який за кольором і формою подібний до осаду, що утворюється при взаємодії К+ з Nа3[Со(NО2)6], тому NН4+-іони заважають проведенню цієї реакції і вони повинні бути відсутні.
Підсумовуючи сказане, можна зробити висновок, що при виявленні іонів K+ за допомогою Nа3[Со(NО2)6] необхідно, щоб розчин був нейтральним або оцтовокислим і в розчині повинні бути відсутні іони NH4+.
Умови виконання реакції. До 2-3 крапель розчину солі калію добавляють 2-3 краплі розчину Nа3[Со(NО2)6]. В присутності іонів К+ випадає осад К2Nа[Со(NO2)6] жовтого кольору.
Осад взмучують і ділять за допомогою піпетки на 3 частини. Досліджують відношення осаду до дії сильної кислоти, лугу і оцтової кислоти.
Виявлення іони К+ за допомогою натрій-свинець гексанітрокупрату (II) мікрокристалоскопічним способом. Іони калію утворюють з Nа2Pb[Сu(NО2)6] осад K2Pb[Сu(NО2)6] чорного або коричневого кольору.

Кристали, які утворилися мають кубічну форму, їх розглядають під мікроскопом.
Реакції виявлення іонів К+ заважають іони NH4+, бо вони теж утворюють осад аналогічної форми і з таким же забарвленням.
Умови виконання реакції. На предметне скло наносять краплю розчину солі калію і випарюють на водяній бані досуха. Після охолодження добавляють до сухого залишку краплю розчину Nа2Pb[Сu(NО2)6] і розглядають кристали, що утворилися, під мікроскопом.
Забарвлення полум’я солями калію. Солі калію забарвлюють полум’я у блідо-фіолетовий колір.
Умови виконання реакції. Платинову пластину занурюють у розчин соляної кислоти і прожарюють у полум’ї, поки не зникне забарвлення. Цю операцію повторюють декілька разів, поки після чергового занурення платинової дротинки в соляну кислоту і внесення її в безбарвне полум’я не зникне блідо-фіолетове забарвлення. Після цього чисту платинову дротинку занурюють у розчин, який досліджується і вносять у полум’я. В присутності сполук калію полум’я забарвлюється в блідо-фіолетовий колір.
Реакції іонів амонію NН4+
Розведений розчин аміаку у воді називають аміачною водою або нашатирним спиртом:

NH4OН - амоній гідроксид відноситься до слабких електролітів. При взаємодії NH4OН з кислотами утворюються амонійні солі. За властивостями ці солі подібні до солей калію. Майже всі солі амонію, за винятком гідротартрату, гексанітрокобальтату (Ш) та хлороплатинату (IV), добре розчиняються у воді.
Реакції іонів амонію. Луги NаОН та КОН при нагріванні виділяють з розчинів солей амонію аміак:

Аміак, що виділяється, можна виявити за запахом або за допомогою червоного лакмусового папірця, змоченого водою, який синіє у парі аміаку внаслідок утворення основи NH4OН:

Якщо в пару аміаку помістити фільтрувальний папір, змочений розчином нітрату ртуті (І), то він чорніє внаслідок виділення металічної ртуті.
При внесенні в газоподібний аміак скляної палички, змоченої концентрованою соляною кислотою, з’являється "білий димок" NH4Сl:

Виконання реакції. До 3-5 крапель розчину солі амонію в пробірці добавляють 5-7 крапель розчину NaOН, пробірку нагрівають і до отвору пробірки підносять червоний лакмусовий папірець, змочений водою, або смужку фільтрувального паперу, змочену розчином нітрату ртуті (І). При цьому червоний лакмусовий папірець синіє, смужка фільтрувального паперу з Нg2(NO3)2 чорніє.
Якщо до отвору пробірки піднести скляну паличку, змочену концентрованою НСl, то з’явиться "білий димок" NH4Сl.
Реактив Несслера К2[HgI4]+КОН іонами амонію утворює аморфний червоно-бурий осад [ОНg2NH2]I.
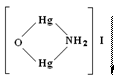


При малих концентраціях іонів NН4+ осад не утворюється, але розчин забарвлюється в жовтий колір.
Реакція надзвичайно чутлива і придатна до виявлення навіть дуже малих ("слідів") концентрацій іонів NН4+.
Виявленню іонів NН4+ за допомогою реактиву Несслера заважають іони Fе3+, Сг3+, Ni2+ та інші, що утворюють при дії лугу нерозчинні у воді забарвлені гідроксиди, а також іони Нg2+, Sn2+, Sb3+, які при взаємодії з йодид-іонами руйнують реактив.
Відношення солей амонію до нагрівання. При високій температурі солі амонію розкладаються. Характер розкладу залежить від природи аніона солі. При прожарюванні амонійної солі леткої кислоти відбувається повна термічна дисоціація солі на аміак і кислоту:

Якщо до складу амонійної солі входить аніон нелеткої кислоти, то при прожарюванні такої солі виділяється тільки аміак:

При прожарюванні амонійної солі з аніоном-окиснювачем аміак окиснюється до азоту або до оксидів азоту:

Катіони другої аналітичної групи Ва2+, Sr2+, Ca2+, Mg2+, Mn2+, Fe2+, Fe3+, Аl3+, Cr3+, Bi3+
Груповим реагентом на ці іони є гідрофосфат амонію (NH4)2HPO4 або гідрофосфати лужних металів, які в присутності гідроксиду амонію утворюють малорозчинні у воді фосфати (див табл. 1). По відношенню до дії оцтової кислоти катіони II групи можна поділити на дві підгрупи: до першої відносять іони Ва2+, Sr2+, Ca2+, Mg2+, Mn2+, Fe2+- фосфати яких розчинні в оцтовій кислоті, а до другої - Fe3+, Аl3+, Cr2+, Bi2+, фосфати яких в оцтовій кислоті не розчиняються, але розчинні в сильних мінеральних кислотах. Більшість сполук катіонів другої аналітичної групи малорозчинні у воді. Розчинними є хлориди, нітрати, нітрити, йодиди, за винятком вісмутe йодида, сульфати, за винятком іонів кальцію, стронцію та барію. Сполуки заліза та хрому здатні окиснюватися, а сполуки вищих ступеней окиснення відновлюватися.
Реакції іонів Ва2+, Са2+, Mn2+, Мg2+
Крім наведених вище групових реакцій на іони Ва2+, Mn, Са2+, які мають багато спільного і в умовах утворення малорозчинних сполук, і в їх властивостях, і у відношенні утворених сполук до дії кислот і лугів, зупинимось на реакціях, які хоч і є груповими на названі іони, але вони характеризуються і відмінностями. Такими реакціями є реакції іонів Ва2+, Mn, Са2+ з хромат- та біхромат-іонами, з оксалат-іонами.
Дія хромат- та біхромат-іонів К2CrO4, К2Сr2О7. Хромат-іони при взаємодії з катіонами Ва2+, утворюють осади ВаСгО4 жовтого кольору:

Кальцій хромат СаСrO4 має досить високу розчинність у воді ( ) і тому при концентраціях, що застосовуються в якісному аналізі, в осад не випадає.
) і тому при концентраціях, що застосовуються в якісному аналізі, в осад не випадає.
Хромати барію і стронцію розчиняються в мінеральних кислотах:

Стронцій до того ж розчиняється і в оцтовій кислоті, в той час як барій хромат в оцтовій кислоті не розчиняється:

При дії біхромат-іонів на іони Ва2+, Sr2+, Са2+ випадає осад тільки ВаCrO4:

Справа в тому, що Сr2О72- - іони у водному розчині взаємодіють з водою і утворюють СrО42- - іони. При цій взаємодії встановлюється рівновага:

при якій концентрація [СгО42-] є достатньою для утворення осаду ВаСгО4 і недостатньою для утворення осаду SrСrО4.
Але і повнота осадження іонів Ва2+ не буде досягнута внаслідок високої концентрації іонів водню, що виділяються по мірі утворення осаду ВаСrО4. Для досягнення повноти осадження ВаСrО4 необхідно понизити концентрацію іонів водню введенням в розчин натрій ацетату. Реакцію осадження ВаСrО4 проводять при рН  4,5.
4,5.
Реакцію утворення ВаСrО4 за допомогою К2Сr2О7 в присутності ацетатного буферного розчину використовують не тільки для виявлення іонів Ва2+, але і для їх відокремлення від іонів Sr2+ і Са2+.
Виконання реакції. До 2-3 крапель розчину в пробірці добавляють 2-3 краплі ацетатного буферного розчину і 2-3 краплі К2Сr2О7. При наявності іонів Ва2+ випадає осад жовтого кольору. Виявленню іонів Ва2+ заважають іони Рb2+, Ag+,Вi+, Hg22+.
Дія оксалатів (NH4)2C204. Амоній оксалат - сіль амонію і оксалатної кислоти Н2С2О4 утворює з іонами Ва2+, Sr2+ і Са2+ білі кристалічні осади:

Осади розчиняються в сильних кислотах (HCl, HNO3), але не розчиняються в оцтовій кислоті.
Реакція утворення малорозчинного кальцій оксалату СаС2О4 частіше за інші використовується для виявлення іонів Са2+. Іони Ва2+, Sr2+ заважають виявленню іонів Са2+ тому вони повинні бути спочатку відокремленими.
Дія гіпсової води СаSО4. Насичений розчин СаSО4 осаджує іони Ва2+ і Sr2+ у вигляді сульфатів:

Концентрація іонів SО42- в насиченому розчині СаSО4 є достатньою для утворення малорозчинних ВаSО4 і SrSО4, оскільки розчинність останніх сульфатів значно менша за розчинність СаSО4. Оскільки добуток розчинності ВаSО4 ( ) значно менший за добуток розчинності SrSО4 (
) значно менший за добуток розчинності SrSО4 ( ) осад ВаSО4 утворюється швидко. Осад SrSО4 утворюється повільно при нагріванні, причому осад з’являється у вигляді каламуті, помутніння розчину. Реакція виявлення іонів Sr2+ за допомогою гіпсової води використовується після попереднього відокремлення іонів Ва2+ від іонів Sr2+.
) осад ВаSО4 утворюється швидко. Осад SrSО4 утворюється повільно при нагріванні, причому осад з’являється у вигляді каламуті, помутніння розчину. Реакція виявлення іонів Sr2+ за допомогою гіпсової води використовується після попереднього відокремлення іонів Ва2+ від іонів Sr2+.
Дія натрію родизонату Na2C6O6 Іони барію утворюють з натрій родизонатом Nа2С6О6

Малорозчинний у воді бурова то-червоний осад барій родизонату BaC6O6

При дії хлоридної кислоти (HCl) утворюється барій гідрородизонат ярко-червоного кольорову.

Виконання реакції. На фільтровальний папір наносять 1 краплю розчину і 1 краплю 0,1% спиртового розчину натрій родизонату. При наявності іонів Ва2+ з’являється буровато-червона пляма, яка при змочуванні розчином НС1 стає ярко-червоною.
Іони Sr2+ також взаємодіють з натрій розидонатом з утворенням стронцій розидонату буровато-червоного кольору SrC6O6. Але на відміну від барій розидонату при дії хлороводневої кислоти забарвлення стронцій розидонату зникає. Тому цю реакцію використовують для виявлення іонів барію в присутності іонів стронцію і іонів стронцію у відсутності іонів барію. Іони важких металів заважають цій реакції.
Виявлення іонів Ba2+ в присутності іонів інших металів. До 5-6 крапель розчину в пробірці добавляють 6 н. розчин NH4ОН до лужної реакції і нагрівають суміш в пробірці до кипіння. При цьому випадають осади гідроксидів металів, за винятком лужних і лужноземельних елементів. Осади гідроксидів відокремлюють центрифугуванням. 2-3 краплі розчину центрифугату наносять на фільтрувальний папір, пляму змочують свіжеприготованим спиртовим розчином натрій родизонату і потім 2 н. розчином НС1. В присутності іонів Ва2+ утворюється гідрородизонат ярко-червоного кольору, який не руйнується в присутності 2 н. НС1.
Реакція виявлення Мg2+ за допомогою амоній або натрій гідрофосфату Nа2HРО4. Іони Мg2+ з натрій гирофосфатом в присутності аміачного буферного розчину утворюють білий кристалічний осад подвійної солі МgNН4РО4.

Осад розчинюється в мінеральних і оцтовій кислотах.
Проведенню реакції заважають іони Ва2+ Са2+, а також. Тому іони Mg2+ виявляють тільки після відокремлення іонів Ва2+, Са2+ іонів важких металів.
Реакція осадження іонів Мg2+ у вигляді подвійної солі часто використовується не тільки в якісному, але і в кількісному аналізі.
Виконання реакції. До 2 - 3 крапель розчину в пробірці добавляють 2 - 3 краплі амоній гідрофосфату, 3 - 5 крапель аміачної буферної суміші і концентрований розчин NH4OH до запаху. Внутрішні стінки пробірки потирають скляною паличкою. В присутності іонів Mg2+ випадає білий кристалічний осад МgNН4РО4.
Виявлення іонів Мg2+ за допомогою магнезону І та магнезону II. Магнезон І (п-нітробензол-азо-резорцин) та магнезон II п-нітробензол-азо-α-нафтол), які в лужному середовищі забарвлені і червоний або червоно-фіолетовий колір, з гідроксидом магнію утворюють адсорбовану сполуку, яка має темно-синє забарвлення.


Виконання реакції. До 2 - 3 крапель розчину добавляють 2 - 3 краплі лужного розчину магнезону І або магнезону II і 10 - 15 крапель 2 н. розчину КОН. В присутності іонів Мg2+ утворюється осад синього кольору або розчин стає синім при малій концентрації іонів Мg2+.
Окиснення іонів Мn2+ в лужному середовищі Як уже відзначалося, луги NаОН і КОН осаджують іони Мn2+ у вигляді білого осаду Мn(ОН)2, який розчиняється в розведених мінеральних кислотах, солях амонію і не розчиняється в лугах.

Осад Mn(OH)2 на повітрі швидко окислюється до Mn(OH)3 і буріє:

При дальшому окисненні Мn(ОН)3 осад чорніє внаслідок утворення МnО(ОН)2
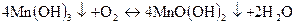
Нас цікавить осад Мn(ОН)3, оскільки він розчиняється в насиченому розчині Н2С2О4 з утворенням [Мn(C2O4)2]- рожевого кольору і ця реакція використовується для виявлення іонів Мn2+:

Виконання реакції В пробірку вносять 2 - 3 краплі розчину, добавляють 3 - 5 крапель розчину NaОН і суміш збовтують, поки осад не стане темно-коричневого кольору. Після цього в пробірку добавляють 5 - 7 крапель насиченого розчину оксалатної кислоти. В присутності іонів Мn2+ розчин забарвлюється в рожевий колір.
Дія пероксиду водню, хлору, брому. Іони Мn2+ в лужному середовищі окиснюються при дії пероксиду водню, хлору, брому і інших окиснювачів до сполук Мn(ІV):
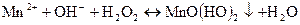
При дії хлорної або бромної води реакція іде за рівнянням:

Якщо реакція відбувається в присутності іонів Сu2+ як каталізатора, то іони Мn2+ окиснюються до МnО4- -іонів.

Виконання реакції. В пробірку вносять 1 краплю розчину, 3-5 крапель лужного розчину бромної води, 5-7 крапель розчину СuSO4. Суміш в пробірці струшують і обережно (рідину може викинути) нагрівають до кипіння. Потім осаду СuО дають осісти. В присутності іонів Мn2+ розчин над осадом забарвлюється в малиново-фіолетовий колір.
Дія аміакату срібла на іони Мп2+. Аміакат срібла [Аg(NH3)2]+. У лужному розчині окиснює іони Мn2+ до Мn(ІV), а сам відновлюється до металічного срібла:

Ця реакція застосовується для виявлення іонів Мn2+ в присутності катіонів II і III аналітичних груп. Реакцію проводять крапельним методом.
Виконання реакції На смужку фільтрувального паперу наносять краплю розчину аміакату срібла і 1-2 краплі досліджуваного розчину. В присутності іонів Мn2+ пляма забарвлюється в коричневий колір.
Оскільки аміакат срібла на фільтрувальному папері частково відновлюється і у відсутності іонів Мn2+ і тому можна помилково виявити іони Мn2+, то слід проводити паралельний дослід з розчином, в якому іони Мn2+ відсутні. Якщо пляма з розчином, що досліджується, виявиться більш інтенсивно забарвленою, ніж пляма паралельного досліду, значить, іони Мn2+ в розчині присутні.
Окиснення іонів Мп2+ в кислому середовищі Іони Мn2+ в кислому середовищі можуть окислюватися до МnО(ОН)2 і до МnО4- - іонів. При дії таких окисників як КClO3 і КBrO3 окиснення проходить до МnО(ОН)2:

Реакція окиснення іонів Мn2+ за допомогою калій бромату застосовується в якісному аналізі для відокремлення іонів Мn2+ від інших катіонів II аналітичної групи.
Виконання реакції. До 5-7 крапель розчину, що досліджується, добавляють 5 - 7 крапель концентрованої азотної кислоти і декілька кристаликів сухої солі КВrО3, суміш нагрівають до кипіння і кип’ятять 3-5 хвилин. Після охолодження осад МnО(ОН)2 відокремлюють центрифугуванням, а розчин використовують для виявлення інших катіонів І підгрупи II аналітичної групи.
Окиснення іонів Мп2+ дією свинець діоксиду РbО2- Іони Мn2+ окиснюються в кислому середовищі до МnО4--іонів, які мають малиново-фіолетове забарвлення. Кращим окисником для цієї реакції є свинець діоксид РbО2:

Виконання реакції. В пробірку вміщують трохи (0,2 г) сухого РbО2, добавляють 10 - 15 крапель концентрованої HNOз і слідові кількості розчину, що досліджується. Для цього кінчик скляної палички змочують розчином, що досліджується, і цей кінчик умочують у розчин HNOз в пробірці. Суміш в пробірці нагрівають до кипіння і кип’ятять 2 - 3 хвилини. Після осідання осаду РbО2 розчин забарвлюється в малиново-фіолетовий колір, якщо в ньому присутні іони Мn2+.
Окиснення іонів Мп2+ дією амоній персульфату (NН4)2S2О8. Амоній персульфат (NН4)2S2О8 в присутності іонів Аg+ як каталізатора окиснює іони Мn2+ до МnО4-. Розчин забарвлюється в малиново-фіолетовий колір:

Виконання реакції У пробірку вміщують 2-3 кристалики (NН4)2S2О8 (або 1,0 мл 50% його розчину), добавляють 0,5 мл 2 н. розчину HNO3 і 2-3 краплі 0,1 н. АgNO3. Суміш нагрівають (не кип’ятять), у гарячий розчин занурюють скляну паличку, змочену досліджуваним розчином, і нагрівають до 50-70°С пробірку протягом 1-2 хвилин. В присутності Мn2+-іонів розчин забарвлюється в малиново-фіолетовий колір.
Виявлення іонів Мп2+ за допомогою бензидину.

Бензидин в кислому середовищі в присутності окисників, в тому числі і МnО(ОН)2, окиснюється в бензидинову синь.
Виявленню іонів Мn2+ за цією реакцією заважають іони Аg+, Ві3+ і окисники.
Виконання реакції. На смужку фільтрувального паперу наносять краплю розчину, що досліджується, на цю краплю добавляють 2 - 3 краплі розчину лугу. При цьому утворюється гідроксид марганцю Мn(ОН)2. Через 3 - 5 хвилин на пляму наносять 1 краплю оцтовокислого розчину бензидину. В присутності марганцю пляма синіє.
Дія калій гексаціаноферату (II) К4[FeCN)6]. В присутності іонів NH4+ калій гексаніаноферат (II) утворює з іонами Са2+ білий осад КNН4Са[Fе(СN)6] або (NH4)2Ca[Fe(CN)6]:
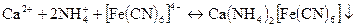
Осад не розчиняється в оцтовій кислоті. Реакцію слід виконувати при рН>7,0. Реакції не заважають іони Sr2+.
Виконання реакції. До 2 - 3 крапель розчину в пробірці добавляють декілька крапель аміачно-амонійного буферного розчину і 2 - 3 краплі К4[Fе(СN)6]. Пробірку з розчином нагрівають до кипіння. При наявності іонів Са2+ випадає білий осад.
Реакція забарвлення полум’я. Леткі солі барію, стронцію і кальцію забарвлюють полум’я в жовто-зелений, карміновочервоний і червоний колір відповідно.
Реакції іонів Fе2+, Al3+
Реакції іонів Fе2+
а) Дія калій гексаціанофорату (III) К3[Fе(CN)6] Іони Fе2+ утворюють з гексаціанофератом (ІІІ)-іонами осад темно-синього кольору, так звану турнбулеву синь Fе3[Fе(СN)6]2.
Ця реакція є характерною для виявлення іонів Fе2+:

Осад не розчинюється в кислотах, але розкладається лугами, в результаті чого утворюється Fе(ОН)2.
б) Окиснення Fе2+ до Fе3+. В той час, як іони Fе3+ проявляють властивості слабого окисника, іони Fе2+ легко окиснюються багатьма окисниками. Для переведення Fе2+ в Fе3+ частіше за інші окисники застосовується азотна кислота при нагріванні:

Реакції іонів Аl3+
Дія NН4ОН А13+-іони при взаємодії з розчином NН4ОН утворюють малорозчинний гідроксид алюмінію А1(ОН)з білого кольору: А1(ОН)з розчиняється у надлишку лугів з утворенням


комплексного гексагідроксоалюміната (II) - іону [А1(ОН)6]3-.
При кип’ятінні лужного розчину [А1(ОН)6]3-; в який введено високу концентрацію NH4+-іонів (насичений розчин солі амонію), випадає білий аморфний осад А1(ОН)3:

Ця реакція часто використовується для виявлення іонів А13+.
Реакція іонів Аl3+ з алізарином S та алюмінатом. - Іони АІ3+ з алізарином S (натрієвою сіллю 1,2-діокснантрахінон-3-сульфокислоти) утворюють внутрішньокомплексну сполуку червоного кольору, яка не розкладається в оцтовій кислоті: А1(ОН)[С14H5O3(OH)2SO3Na]2. Іони Fе3+, Вi3+, Сu2+ заважають реакції, оскільки вони теж утворюють забарвленні осади.
 |


За цією реакцією іони АІ3+ виявляють в слабкокислому середовищі при рН=4,2-4,6. В таких умовах алізарин S має жовтий колір. У лужному середовищі реактив має фіолетове забарвлення, маскує при цьому червоний колір алізаринату алюмінію і заважає виявленню іонів АІ3+.
Виконання реакції. До 3-5 крапель розчину, в якому виявляють іони А13+, добавляють 2 н. розчин NаОН до сильно лужної реакції. Якщо випадає осад, його відокремлюють центрифугуванням. До прозорого центрифугату додають 2-4 краплі 0,2% розчину алізарину S при цьому розчин забарвлюється у фіолетовий колір, і окремими краплями - 2 н. розчин оцтової кислоти до зникнення фіолетового забарвлення. Поява червоного осаду або червоного забарвлення свідчить про наявність в розчині іонів АІ3+.
Реакцію можна виконати краплинним способом. Для цього на смужку фільтрувального паперу наносять краплю розчину K4[Fe(CN)6] і в центр утвореної плями вносять краплю розчину, в якому виявляють іони А13+. При цьому всі катіони II, III і V аналітичних груп, які можуть заважати виявленню іонів Аl3+, осаджуються у вигляді малорозчинних гексаціанофератів і залишаються в центрі плями, тоді як іони А13+ дифундують на периферію плями.
Після цього пляму обробляють аміаком; тримаючи папір з плямою над отвором склянки з розчином аміаку і змочують зовнішню зону плями розчином алізарину S. Потім знову обробляють пляму газоподібним аміаком. Папір з плямою висушують і зовнішню зону плями змочують розчином оцтової кислоти. Поява рожевого кільця на зовнішній зоні плями свідчить про наявність в розчині іонів А13+.
Алюмінон-амонійна сіль ауринтрикарбонової кислоти:

утворює з іонами А13+комплексну сполуку червоного кольору.
Виконання реакції. До 2-3 крапель розчину добавляють 2-3 краплі оцтової кислоти, 2-4 краплі 0,1% розчину алюмінону, нагрівають, добавляють розчин NH4ОН до запаху і 2-3 краплі 2М розчину (NН4)2СОз. У присутності іонів А13+ випадає червоний осад або розчин забарвлюється в червоний колір.
Іони Fе3+, Вi3+, Сu2+ та деяких інших металів заважають, виявленню іонів алюмінію за цією реакцією. їх можна відокремити від іонів Аl3+ осадженням гідроксидів надлишком NаОН або КОН. Потім прозорий центрифугат, в якому знаходяться гідроксоалюмінат-іони [Аl(OН)6]3- підкислюють оцтовою кислотою і далі реакцію виявлення іонів Аl3+ виконують, як описано вище.
Реакції іонів Fe3+
Дія NH4ОН на іони Fe3+, Вi3+. При взаємодії іонів Fе3+ і Ві3+ з розчином NH4ОН утворюються осади коричневого гідроксиду заліза Fе(ОН)3 і білого гідроксиду вісмуту Ві(ОН)з:

Осади розчиняються в кислотах, але не розчиняються в лугах і надлишку гідроксиду амонію
Дія гексаціаноферату (II і III) К4Fе(СN)6] і K3[Fe(CN)6]. Іони Fe3+ утворюють з калій гексаціанофератом (II) темно-синій осад Fe4[Fe(CN)6] так званої “берлінської лазурі”:

Ця реакція є характерною реакцією на іони Fе3+. Осад Fе4[Fе(СN)6]3 не розчиняється в розведених мінеральних кислотах, але розчиняється при добавленні великого надлишку реактиву. При дії лугів осад розкладається з утворенням гідроксиду заліза (III):
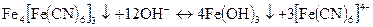
Перебігу реакції заважають аніони, які утворюють з іонами Fе3+ більш стійкі комплексні сполуки: PO43-, C2O42-, F- тартрат-іони та інші.
Виконання реакції. До 2-3 крапель розчину в пробірці добавляють 2-3 краплі розчину К4[Fе(СN)6]. В присутності Fе3+-іонів утворюється осад синього кольору.
Реакція придатна для виявлення іонів Fе3+ в суміші катіонів всіх інших аналітичних груп.
Калій гексаціаноферат (III) К3[Fе(СN)6] утворює з іонами Fе3+ осад темно-коричневого кольору Fe[Fe(CN)6]:

Дія амоній тіоціанату NH4SCN(KSCN). Іони заліза Fе3+ з роданід-іонами утворюють комплексні сполуки інтенсивно-червоного кольору, в яких склад може змінюватися від Fе(SCN)2+ до [Fе(SCN)б]3- Реакцію виконують в кислому середовищі при рН=2. Виявленню іонів Fе3+ за допомогою тіоціанат-іонів заважають F-, РО43--іони, тартрати, які утворюють з іонами Fе3+ більш стійкі безбарвні сполуки, ніж комплекси заліза (III) з тіоціанат-іонами:

а також сильні окисники, які окиснюють SCN- iони, і сильні відновники, які відновлюють іони Fе3+ до Fе2+-іонів.
Виконання реакції. До 2 - 3 крапель розчину добавляють 1 - 2 краплі хлороводневої кислоти і 3 - 4 краплі розчину (NН4)SCN або КSCN. В присутності іонів Fе3+ розчин забарвлюється в інтенсивно червоний колір.
Реакції іонів Сr3+
Дія NH4OH на іони Сr3+. Іони Сг3+ при взаємодії з розчином NН4ОН утворюють малорозчинний гідроксид хрому Сг(ОН)3 сіро-зеленого кольору.
Cr3++3NH4OH↔Cr(OH)3↓+3NH4+
Осад Сг(ОН)3 розчиняється в кислотах і надлишку лугів:
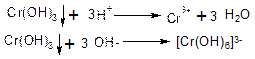
Окиснення іонів Сr3+ до СrО42- іонів в лужному середовищі. В лужному середовищі іони Сг3+ окиснюються до СгО42_ при дії хлорної, бромної води або пероксиду водню:


Іони СгО42_ жовтого кольору. Наявність іонів СrO42- можна підтвердити утворенням в кислому середовищі при дії пероксиду водню надхромової кислоти Н2СrO6 синього кольору.
Виконання реакції. До 3 - 5 крапель розчину, в якому виявляють іони Сг3+, добавляють по краплям розчин NаОН чи КОН до сильнолужної реакції, 5 - 7 крапель 3% розчину Н2О2 і нагрівають розчин до кипіння. Поява жовтого забарвлення внаслідок утворення іону СгО42- свідчить про присутність іонів Сr3+ в розчині.
Потім до 3-5 крапель розчину, одержаного після окиснення іонів Сr3+ до СrО42-, добавляють по краплям НС1 або Н2SО4 до кислої реакції і 0,5 см3 амілового спирту, 5 - 7 крапель розчину Н2О2 і вміст пробірки збовтують. В присутності Сr2О72-_ іонів верхній шар амілового спирту забарвлюється в інтенсивно-синій колір внаслідок утворення легкорозчинної в ньому надхромової кислоти.
Окиснення іонів Сr3+ амоній або калій персульфатом (NH4)2S2O8 (K2S2O8) відбувається в азотнокислому середовищі і в присутності нітрату срібла як каталізатора:


Виконання реакції. До 2 - 3 крапель розчину, в якому виявляють іони Сг3+, добавляють 3-5 крапель 2 н. HNО3, 2 - 3 краплі 0,1 н. розчину АgNO3 5 - 7 крапель 50% розчину (NН4)2S2О8 і суміш нагрівають. В присутності іонів Сг3+ розчин забарвлюється в жовтий колір, внаслідок утворення Сг2О72- іонів. Якщо в розчині присутні іони Мn +2, то з’являється малиново-фіолетове забарвлення, яке обумовлене утворенням іонів МnО4-. Для їх розкладу, а значить і окиснення іонів Cr3+ перманганатом калію КМпО4 відбувається в азотнокислому або сірчанокислому середовищі і у відсутності іонів Сl-, бо останні окиснюються перманганатом і заважають перебігу реакції.
Виконання реакції. До 3 - 5 крапель розчину добавляють З краплі 2 н. розчину Н2S04 або НN03, 1 мл 0,1 н. розчину КМnО4 нагрівають протягом 3 - 5 хвилин. У присутності іонів Сг3+ розчин іабарвлюється в оранжевий колір. У частині розчину після охолодження виявляють іони Сг2О72- утворенням надхромової кислоти Н2СrО6.
Окиснення іонів розчином КМnО4 в слабокислому середовищі супроводжується утворенням темно-бурого осаду МnО(ОН)2:

Осад МпО(ОН)2 відокремлюють від розчину центрифугуваням, а в розчині іони Сг2О72- іони виявляють дією Н2О2 в кислому середовищі і утворенням надхромової кислоти Н2СrO6.
Реакції осадження СrО42-(Сr2О72-) іонів. З іонами Аg+, Hg2+, Рb2+ іони СгО42- (Сг2О72-) утворюють малорозчинні хромати:

Осад Аg2СгО4 цеглисто-червоного кольору, розчиняється в HNО3, і в NH4OH:

Осад ВаCrO4 жовтого кольору розчиняється в мінеральних кислотах, але не розчиняється в оцтовій кислоті.

Осад PbCrO4 розчиняється в HNO3 і лугах:

Виявлення іонів Сr3+ в присутності катіонів інших груп.
Бензидин окиснюється біхромат-іонами в кислому середовищі до бензидинової сині: 
Виконання реакції. На годинникове скельце наносять краплю розчину, 2 краплі 3% розчину Н2О2, 2—3 краплі 6 н. NaОН. Суміш трохи нагрівають. Потім за допомогою капілярної трубочки обережно переносять розчин з осадом на фільтрувальний папір так, щоб осад утворювався на папері в місці дотику капіляра. Іони СrO42 дифундують до периферії плями і навколо осаду утворюється кільце, в якому заходяться іони СгО42. Кільце змочують оцтовим бензидином. В присутності СгО42- іонів навколо центра плями утворюється синє кільце. Утворення забарвлених перлів бури з солями хрому.
Н атрій тетраборат Na2В4О7∙10Н2О при сплавленні з сполуками хрому утворює забарвлені в смарагдово-зелений колір перли хромметаборату


Реакції іонів Вi3+
Дія біхромат-іонів на іони Вi3+(К2Сr2О7). Біхромат калію К2Сг2О7 в ацетатному буферному розчині (рН=4-5) утворює з іонами Ві3+ осад біхромату вісмутила (ВіО)2Сг2О7 жовтого кольору:

Біхромат вісмутилу розчиняється в мінеральних кислотах і не розчиняється, на відміну від РbСгО4, в лугах.
Взаємодія солей вісмуту з водою. Солі вісмуту, особливо хлориди, гідролізуються, в результаті чого утворюється білий осад вісмутилу хлориду

Дія на іони Ві3+ йодиду калію КI. Калій йодид утворює з іонами Ві3+ чорний осад вісмут йодиду ВіІ3. ВіІ3 розчиняється в надлишку реактиву, внаслідок чого утворюється темно-оранжева комплексна сполукa К[ВіІ4]: 
Комплекс КВіІ4 використовується як характерний реагент на алкалоїди (стрихнін, хінін та інші), з якими він утворює сполуки, що не розчиняються у воді.
Реакції відновлення іонів Bi3+ металами: Zп, Fе. Іони вісмуту Ві3+ відновлюються такими металами як залізо, цинк до металічного стану:

Реакцію виконують в слабкокислому середовищі при рН<7. Перебігу реакції заважають іони Аg+, Нg22+, Нg2+, SbШ, SbV, Сu2+, Аs1II, АsV та деякі інші.
Відновлення іонів Під дією натрій гексагідроксостанату (II) Na4[Sn(OH)6] Іони Ві3+ відновлюються гідроксостанатом (II) [Sп(ОН)6]4- в лужному середовищі до металічного вісмуту чорного кольору:

Перебігу реакції заважають іони Аg+, Нg22+, Нg2+. Гексагідроксостанат (II) повинен бути свіжо-приготовленим. Для цього до розчину SnС12 добавляють NаОН чи КОН, при цьому випадає осад Sп(ОН)2, який розчиняють в надлишку лугу:

Виконання реакції. До 2 - 3 крапель розчину SnС12 в окремій пробірці добавляють при перемішуванні розчин NаОН до повного розчинення осаду Sn(ОН)2. В другій пробірці до 2 - 3 крапель розчину, в якому виявляють іони Ві3+, добавляють в надлишку розчин NaOH при цьому випадає осад гідроксидів металів. До цього осаду приливають розчин гексагідроксостанату (II) з першої пробірки. Почорніння осаду свідчить про присутність іонів Ві3+. При виконанні реакції виявлення іонів Ві3+ за допомогою гексагідроксостанату (II) слід уникати великого надлишку концентрованого розчину лугу: в сильно лужному розчині внаслідок реакції диспропорціювання [Sn(ОН)6]4- може випасти металічне олово у вигляді чорного осаду:

Не нашли, что искали? Воспользуйтесь поиском: