
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Дія а-нітрозо-р-нафтолу

Іони Со2+ окиснюються (α-нітрозо-β-нафтолом до кобальту (III), який і утворює осад Со(С]0Н6NОО)3 червоно-бурого кольору. Осад не розчиняється в мінеральних кислотах.
Аналогічні реакції дають іони Fе3+,Сu2+, Нg2+. Але осади цих металів, на відміну від осаду кобальту з α-нітрозо-β-нафтолом, розчиняються в мінеральних кислотах.
Виконання реакції. До 2 - 3 крапель розчину додають 3 - 4 краплі 6 н. розчину НС1 і нагрівають суміш до кипіння. Потім в гарячий розчин добавляють 3 - 4 краплі свіжоприготовленого насиченого розчину реактиву в 50% оцтовій кислоті і знову нагрівають. У присутності іонів Со2+ випадає червоно-бурий осад або розчин забарвлюється в червоний колір.
Дія нітриту калію KNO2. Нітрит калію, добавлений в надлишку до не дуже розбавленого розчину солі Со2+, підкисленого оцтовою кислотою, утворює жовтий кристалічний осад К3[Со(N02)6]:

Виконання реакції. До 2 - 3 крапель розчину добавляють 5 - 8 крапель 10% розчину КNO2 або суміші NaNО2 і КС1, 3 - 5 крапель 2 н. розчину оцтової кислоти і суміш збовтують. Поява жовтого кристалічного осаду свідчить про присутність іонів Со2+.
Утворення перлів бури (реакція сухим способом).
При сплавленні сполук кобальту з бурою Na2В4О7∙10H2O утворюються перли синього кольору. Великі кількості нікелю заважають реакції тому, що забарвлюють перли в бурий колір.
Виявлення іонів Co2+ в суміші катіонів всіх аналітичних груп. До 2 - 3 крапель розчину вносять кристалик NН4СSN і 10 крапель амілового спирту.
Суміш збовтують. Якщо шар амілового спирту забарвлюється в червоний колір (наявність Fе3+-іонів), то в розчин вносять декілька кристаликів NaF до зникнення червоного кольору. В присутності Со2+-іонів шар амілового спирту забарвлюється в синій колір.
Реакції іонів Nі2+
Дія калій гексаціаноферату (II, III) К4[Fe(CN)6] К3[Fe(CN)6] Калій гексаціаноферат (II) утворює з іонами Ni жовто-зелений осад нікель гексаціаноферату (II) Nі2[Fе(СN)6], який не розчиняється в кислотах, але розчиняється в концентрованому розчині аміаку:
Калій гексаціаноферат (III)утворює з іонами Ni2+ жовто-бурий осад нікель гексаціаноферату (III) Ni3[Fе(СN)6]2:
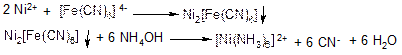
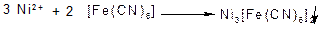
Реакція з диметилгліоксимом. Іони нікелю в аміачному середовищі (рН=9) утворюють з диметилгліоксимом червоний осад внутрішньо комплексної солі диметилгліоксимату нікелю. Реакції заважають іони Fе2+ і Сu2+
Виконання реакції. 2-3 краплі розчину містять в пробірку, добавляють 1-2 краплі розчину NН4ОН, 2 краплі 1% спиртового розчину диметилгліоксиму. В присутності Nі2+- іонів випадає червоний осад:
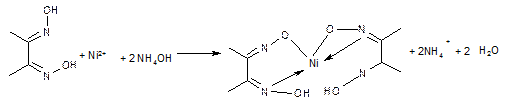
Утворення перлів бури (реакція сухим способом). При сплавленні сполук нікелю з бурою Na2В4О7∙10Н2О утворюються перли Na2Ni(ВО2)4 червоно-коричневого кольору.
Виявлення іонів Ni+2 в присутності катіонів інших аналітичних груп. Як уже зазначалось, виявленню іонів Ni2+ за допомогою диметилгліоксиму заважають іони Fе2+ і Сu2+. Для усунення впливу Fе2+-іонів їх переводять дією азотної кислоти в Fе3+-іони, які потім зв’язують в безбарвні фторидні або тартратні комплексні іони Fе3+:
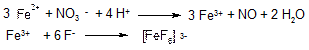
Для усунення впливу Сu2+ -іонів останні переводять в присутності Na2SО3 дією тіоціанат-іонів SCN в осад СuSCN і відокремлюють центрифугуванням
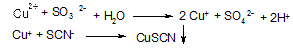
Виконання реакції. До 3-5 крапель розчину добавляють 2-3 краплі НNО3, суміш в пробірці нагрівають до кипіння. Потім добавлянні в пробірку 2-3 краплі насиченого розчину NaF, 2-3 краплі розчину Na2SО3, 2-3 краплі розчину NH4SCN і знову нагрівають. Після охолодження відокремлюють СuSСN центрифугуванням, а до розчину додають краплями NН4ОН до створення аміачного середовища і 2-3 краплі спиртового розчину диметилгліоксиму. В присутності Ni+-іонів випадає червоний осад диметилгліоксимату нікелю.
Реакції іонів Zn2+
Дія калій гексаціаноферату (II, III) К4[Fе(СN)6], К3[Fе(СN)6]. Іони Zn2+ з калій гексаціанофератом (II) утворюють білий осад К2Zn3[Fе(СN)6]2:

Осад К2Zn3[Fе(СN)6]2: не розчиняється в кислотах, але розчиняється в лугах з утворенням цинкату. Реакції заважають Fе3+, Сu2+, Сd2+, Нg2+, Аg+ та інші іони.
Виконання реакції. До 2-3 крапель розчину добавляють краплю розчину калій гексаціаноферату (II). В присутності іонів Zn2+ випадає білий осад. Взаємодія іонів Zn2+ з калій гексаціанофератом (III)К3[Fе(СN)6] приводить до утворення коричнево-жовтого осаду Zn3[Fе(СN)6]2 або КZn[Fе(CN)6]. Реакції заважають Fе3+, Fе2+, Сu2+, Сd2+ та багато інших іонів.
Дія амоній тетрароданомеркурата (II) (NH4)2[Hg(SCN)4]. Амоній тетрароданомеркурат (II) з іонами Zn2+ утворює осад Zn[Hg(SCN)4] білого кольору, а з іонами Сu2+ - осад Сu[Нg(SCN)4] зеленого кольору. Якщо іони Zn2+, Сu2+ в розчині присутні одночасно, то при дії (NH4)2[Hg(SCN)4] випадає осад фіолетового кольору:
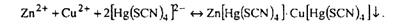
Виконання реакції. До 2-3 крапель розчину в пробірку додають 1 краплю розведеної сірчаної кислоти, 2-3 краплі 0,1 % розчину СuSО4·5Н2О і 3-4 краплі розчину (NH4)2[Hg(SCN)4]. Внутрішні стінки пробірки потирають скляною паличкою. В присутності іонів Zn2+ випадає осад фіолетового кольору.
При виконанні даної реакції необхідно звернути увагу на концентрацію іонів Сu2+ в розчині: вона повинна бути невисокою. При високій концентрації іонів Сu2+ може випасти індивідуальна комплексна сіль міді Сu[Нg(SCN)4] зеленого кольору.
Подвійну забарвлену в блакитний колір комплексну сіль іони Zn2+ з (NН4)2[Нg(SCN)4] утворюють і в присутності іонів Со2+:

Дія сірководню Н2S. Іони Zn2+ осаджуються у вигляді білого осаду ZnS при дії Н2S в нейтральному, слабколужному або слабкокислому середовищі:

Найчастіше цією реакцією користуються в слабкокислому середовищі при рН=2. В цих умовах не осаджуються іони Со2+, Ni+2, Мn2+, Fе2+ і тому вони не заважають виявленню іонів Zn2+. Розчин з рН=2 створюють добавлянням форміатного буферного розчину, тобто, суміші форміатної кислоти та її солі. Але виявленню іонів Zn2+ дією Н2S при рН=2 заважають іони металів, які утворюють сульфіди менш розчинні, ніж сульфід цинку. Тому ці іони повинні бути відокремлені. Це іони Сd, Вs, Рb2+, Сu2+, Аg+, Нg2+, Sn2+, SЬШ, SЬV.
Утворення кобальт цинкату (реакція сухим способом). Смужку фільтрувального паперу змочують розчином, в якому виявляють іони Zn2+, і розчином Со(NO3)2, висушують і спалюють. В присутності цинку утворюється кобальт цинкат ("ринманова зелень"), який забаpвлює золу в зелений коліp:

Проведенню реакції заважають іони А13+, які утворюють в аналогічних умовах золу темно-синього кольору, так звану "тенарову синь", а також іони Сг3+, Nі2+, Сu2+, які власним забарвленням маскують колір золи.
Виявлення іонів Zn2+ в суміші катіонів інших груп. 3-4краплі розчину містять в пробірку, добавляють надлишок розчину NH4OH, осад гідроксидів важких металів відокремлюють центрифугуванням. Центрифугат (розчин) підкислюють оцтовою кислотою до кислого середовища і нагрівають до кипіння. Якщо при цьому утворюється осад, його відокремлюють центрифугуванням. Відбирають 3-4 краплі лужного розчину, який нейтралізують добавлянням 2 н. НС1. Розчин НС1 добавляють краплями до рН=2, потім додають 1-2 краплі К4[Fе(СN)6]. Якщо в розчині присутні іони Zn2+, випадає білий осад.
Реакції іонів Сd2+
Дія калій гексаціаноферату (II)) К4[Fе(СN)6], Калій гексаціаноферат (II) утворює з іонами Сd2+ білий осад кадмій гексаціа-ноферату (II)) Cd2[Fе(СN)6], який розчиняється в мінеральних кислотах:
Cd2+ + К4[Fе(СN)6]  Cd2[Fе(СN)6]
Cd2[Fе(СN)6]
Не нашли, что искали? Воспользуйтесь поиском: