
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Визначення концентрації розчину соляної кислоти.
Щоб визначити концентрацію розчину кислоти, застосовують такі вихідні речовини: Na2B4O7·10H2O - натрій тетраборат, Na2CO3 - натрій карбонат, KHCO3 – калій гідрокарбонат, KIO3 – калій іодат та ін. 
Принцип методу. Для визначення концентрації HCl застосовують метод окремих наважок. При титруванні натрій тетраборату хлоридною кислотою відбуваються реакції:
Na2B4O7+7H2O→2NaOH+4H3BO3
2NaOH+2HCl→2NaCl+2H2O
----------------------------------------------------------
Na2B4O7+2HCl+5H2O→4H3BO3+2NaCl
Для визначення точки еквівалентності, застосовують індикатор, показник титрування (рТ) якого близький до рН у точці еквівалентності. У точці еквівалентності розчин містить тільки хлорид натрію (рН=7) та борну кислоту Н3ВО3, яка зумовлює слабо кислу реакцію розчину. Значення рН розчину у точці еквівалентності можна розрахувати за формулою для обчислення рН розчинів слабких кислот:
pH=  рК1 (H3BO3 ) −
рК1 (H3BO3 ) −  lgC(H3BO3),
lgC(H3BO3),
pK1(H3BO3)=−lgK1(H3BO3), pK1(H3BO3)=9,24,
C(H3BO3)=0,1M, pH=  ·9,24 −
·9,24 −  lg10-1=5,12
lg10-1=5,12 
Титрування буде більш точним тоді, коли застосувати індикатор з показником титрування 5,12 або близьким до цього значення. Таке значення рН у точці еквівалентності відповідає показнику титрування метилового червоного (рТ=5,5).
Обчислення маси наважки. Натрій тетраборат має перевагу при використанні його для встановлення концентрації НСl, тому що має велику молярну масу еквівалента.
M ( Na2B4O7 · 10H2O)=
Na2B4O7 · 10H2O)=  =190,71
=190,71 
Hаважку обчислюють з огляду на рівність кількості моль-еквівалентів реагуючих речовин, а саме:
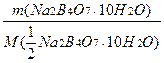 =
= 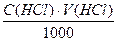
Концентрація кислоти (НСl) 0,1М, об'єм кислоти беруть такий, щоб на титрування було достатньо однієї заповненої бюретки. Якщо користуються бюреткою на 25 мл, то для обчислення наважки беруть 20,0 мл:
m (Na2B4O7·10H2O)=  =0,38г.
=0,38г.
Хід аналізу. Наважку натрій тетраборату близько 0,38 г зважують на аналітичних терезах, висипають її в колбу для титрування, розчиняють у гарячій воді приблизно 50 мл. Розчин охолоджують до кімнатної температури, додають 1-2 краплі метилового червоного і титрують розчином НСl до зміни забарвлення розчину від жовтого до червоного.
Титрування проводять тричі. Концентрацію хлоридної кислоти розраховують за формулою:
C(HCl)= 
Контрольні питання.
1. Які вихідні речовини використовують для встановлення нормальності кислот? Їх переваги та недоліки.
2. Розрахуйте яку наважку натрію тетраборату потрібно взяти для встановлення молярності ~0,5 М розчину соляної кислоти.
3. За яким методом концентрація НСl буде визначена точніше – методом пипетування чи методом окремих наважок?
4. Обчисліть рН в точці еквівалентності.
5. Чи впливає температура на результати титрування?
Лабораторна робота № 6 Приготування робочого розчину натрію гідроксиду з наважки та визначення його концентрації за оксалатовою кислотою. Визначення масової частки лимонної (винної) кислоти.
Мета: Приготувати розчин натрію гідроксиду з наважки та визначити його концентрацію за оксалатовою кислотою. Визначити масову частку лимонної (винної) кислоти.
Обладнання та посуд:.
1. Бюретка, 25 мл.
2. Мірна колба, 250 (200) мл.
3. Піпетка, 25 (20) мл.
4. Колба для титрування, 300мл.
5. Оксалатова кислота.
1. Індикатор – фенолфталеїн.
Завдання:
1. Приготувати розчин натрію гідроксиду.
2. Визначити концентрацію натрію гідроксиду за оксалатовою кислотою.
3. Визначити масову частку лимонної (винної) кислоти.
Приготування розчину натрію гідроксиду. Приготувати титрований розчин натрій гідроксиду розчиненням точної наважки NaOH неможливо, оскільки NaOH не відповідає вимогам вихідної речовини.
Їдкий натр являє собою кристалічну речовину білого кольору, яка поглинає вологу (тому на повітрі розпливається) і легко реагує з CO2 повітря з утворенням Na2CO3. Тобто, склад натрію гідроксиду невідомий, тому що він забруднений деякою кількістю карбонату натрію і води.
Для приготування титрованого розчину натрію гідроксиду спочатку готують розчин приблизної концентрації, а точну концентрацію визначають за вихідною речовиною, або за титрованим розчином кислоти. Для визначення органічних кислот зазвичай готують приблизно 1 М розчин натрію гідроксиду. Наважку NaOH, необхідну для приготування розчину, розраховують за формулою:
m(NaOH)=  ; M(NaOH)=40
; M(NaOH)=40 
Якщо необхідно приготувати 500 мл 1 М розчину NaOH, то:
Vконц(NaOH)= 
Розчин NaOH потрібної концентрації можна отримати і шляхом розбавлення більш концентрованого розчину лугу. В цьому випадку спочатку вимірюють густину концентрованого розчину лугу, за таблицею (довідник) знаходять молярну концентрацію розчину лугу і розраховують об'єм за формулою:
Визначення концентрації розчину натрій гідроксиду за оксалатовою кислотою Оксалатова кислота задовольняє вимогам вихідних речовин і реагує з NaOH за рівнянням:
Н2С2О4+2NaOH→Na2C2O4+2Н2О
Оксалатова кислота є слабкою кислотою (К1=6,5∙10-2, К2=6,1∙10-5). Вона титрується як двоосновна кислота, але на кривій титрування помітний лише один стрибок рН, так як К1⁄К2<104. Визначення концентрації розчину натрій гідроксиду за оксалатовою кислотою здійснюють методом піпетування. Наважку кислоти розраховують з огляду на рівність кількості моль-еквівалентів Н2С2О4 ·2Н2О та NaOH
n(H2C2O4)=n(NaOH)
 =
= 
Молярна маса еквівалента оксалатової кислоти дорівнює половині молярної маси, тобто 126,07⁄2=63,04 г⁄моль.
Якщо Vk (об'єм колби)=250 мл, а Vп (об'єм піпетки)=25 мл, і титрують із бюретки 25,0 мл, то
m(H2C2O4 ∙2H2O) =  =12,5г.
=12,5г.
При титруванні оксалатової кислоти розчином натрій гідроксиду у точці еквівалентності розчин містить натрій оксалат, який гідролізує за першим ступенем, що обумовлює відповідну кислотність розчину:
С2O42- + H2O → HC2O4- + OH-
Гідроліз за другим ступенем незначний, тому
pH=7+  lgK2
lgK2  +
+  lgCсолі
lgCсолі
Таким чином, для фіксації точки еквівалентності при титруванні оксалатової кислоти розчином натрій гідроксиду слід використовувати фенолфталеїн (рТ=9) як індикатор.
Хід аналізу. Наважку оксалатової кислоти (Н2С2О4·2Н2О) близько 12,5 г зважують на аналітичних терезах, переносять у мірну колбу і розчиняють у дистильованій воді. Після повного розчинення оксалатової кислоти розчин доводять водою до мітки, ретельно перемішують. Відбирають піпеткою 20 (25) мл аліквотну частку (Vп) розчину, переносять її в колбу для титрування, розбавляють водою приблизно до 50 мл, добавляють 7-8 крапель фенолфталеїну і титрують розчином NaOH, концентрацію якого визначають, до появи рожевого забарвлення, яке не зникає протягом 20-30с. Титрування повторюють 3-4 рази. Концентрацію NaOH розраховують за формулою.
C(NaOH)= 
Визначення масової частки лимонної (винної) кислоти. Метод заснований на нейтралізації лимонної (винної) кислоти 1 н. розчином натрію гідроксиду в присутності фенолфталеїну.
Хід аналізу: на аналітичних терезах зважують приблизно 2 г наважки кислоти з точністю 0,0002г. Наважку кількісно переносять в конічну колбу місткістю 250см3 і розчиняють в 50 см3 дистильованої води. Додають до розчину 3-5 крапель фенолфталеїну і титрують 1М розчином натрію гідроксиду до появи слабко рожевого забарвлення, яке не зникає протягом 1 хвилини.
Масову частку кислоти W (у %) розраховують за формулою:
W(кислоти)=  ;
;
Контрольні питання.
1. Чому неможливо приготувати титрований розчин натрій гідроксиду розчиненням точної наважки NaOH?
2. Якими домішками може бути забруднений NaOH?
3. Розрахуйте яку наважку натрію оксалатової кислоти потрібно взяти для встановлення молярності ~1 М розчину NaOH.
4. За яким методом концентрація NaOH буде визначена точніше – методом пипетування чи методом окремих наважок?
5. Обчисліть рН в точці еквівалентності.
6. Чому для титрування лимонної або винної кислоти необхідно як індикатор використовувати фенолфталеїн?
Перманганатометрія
Перманганатометрія - метод, заснований на використанні калій перманганату як титранта для визначення сполук, які мають відновні властивості.
Продукти відновлення перманганат-іонів можуть бути різними, залежно від рН середовища:
•в сильнокислому середовищі: MnO4-+5ē+8Н+→Мn2++4Н2O, Е0=1,51В
•в слабколужному або нейтральному середовищі:
MnO4-+3ē+4Н2O→МnO2↓+4OH-, Е0=0,60В
Для аналізу частіш за все використовують окисні властивості MnО4--іонів в кислому середовищі, тому що продуктом їх відновлення є безбарвні іони Мn2+ (на відміну від бурого осаду МnО2), на фоні яких чітко видно забарвлення від надлишкової краплі розчину титранту.
Необхідне значення рН середовища створюють за допомогою розчину сірчаної кислоти. Інші сильні мінеральні кислоти не використовують. Так, хлороводнева кислота (HCl) при певних умовах (в присутності Fe2+-іонів) взаємодіє з KMnO4 і відбувається індуктивна реакція окиснення хлорид-іонів:
2МnО4-+16Н++10Сl-↔2Мn2++5С12+8Н2О
Тому, калії перманганат витрачається як на окислення речовини що титрується, так і на часткове окиснення Сl--іонів, тобто результати титрування виявляються завищеними.
Титрант методу - розчин калій перманганату (С1/5 KMnO4) - готують і стандартизують за стандартними речовинами: щавлевою кислотою, натрію оксалатом, арсену (Ш) оксидом, сіллю Мора тощо.
Встановлення кінцевої точки титрування виконується безіндикаторним (за забарвленням надлишку перманганат-іонів) методом.
Лабораторна робота № 7 Приготування та стандартизація робочого розчину KMnO4
Мета: Приготувати та стандартизувати робочий розчин KMnO4.
Обладнання та посуд:.
1.Бюретка, 50,0 мл;
2.Колба для титрування;
3.Мірний циліндр, 50 мл;
4.Оксалатова кислота(H2C2O4∙2H2O);
5.Сірчана кислота H2SO4 (1:4);
6.Розчин KMnO4.
Завдання:
1. Приготувати розчин KMnO4.
2. Визначити концентрацію робочого розчину KMnO4
Калій перманганат не задовольняє вимогам вихідних речовин і тому приготувати його робочий розчин виходячи з наважки немає можливості. ПрепаратKMnO4 завжди містить домішки MnO2 і інших продуктів його відновлення.
Розчини KMnO4 нестійкі, так як має місце реакція:
4MnO4-+2H2O  4MnO2+3O2+4OH- E0=0,187В.
4MnO2+3O2+4OH- E0=0,187В.
Швидкість цієї реакції дуже мала, її прискорюють кислоти, основи, солі мангану (II) і, особливо MnO2 а, також нагрівання і дія світла.
Для одержання стійкого титрованого розчину KMnO4 необхідно відокремити від нього манган діоксид. Оскільки запобігти реакції між перманганатом і органічними речовинами, які є у дистильованій воді, неможливо, слід дати можливість дійти цій реакції до кінця.
Після розчинення KMnO4 у воді, розчин нагрівають для прискорення реакції і дають відстоятися. Відокремлюють осад MnO2 за допомогою скляних фільтрів або зливають розчин над осадом. Зберігають розчин KMnO4 у посуді з темного скла.
Робочий розчин KMnO4 має концентрацію близько (С1/5KMnO4)=0,1моль/л. Для приготування 1 л розчину беруть наважку m=0,1∙31,61=3,16 г, де 31,61- молярна маса еквівалента KMnO4=M(1/5KMnO4).
Визначення концентрації розчину KMnO4. Для визначення точної концентрації розчину калій перманганату використовують вихідні речовини: арсену оксид (As2O3), натрій оксалат (Na2C2O4), оксалатову кислоту (H2C2O4∙2H2O), солі заліза (II). Найчастіше використовують оксалатову кислоту або натрій оксалат. При титруванні відбувається реакція:
5C2O42-+2MnO4-+16H+→2Mn2++8H2O+10CO2
Окиснення C2O42- відбувається за схемою:
C2O42-+2ē  2CO2
2CO2
Особливістю цієї реакції є те, що перші краплі розчину KMnO4 реагують дуже повільно і тільки у підігрітому до 700C розчині наступні порції титранту реагують все швидше і швидше і, нарешті, реакція стає миттєвою. Так відбуваються реакції, у яких один із продуктів є каталізатором реакції, такі реакції називаються автокаталітичними, а каталізатори – автокаталізаторами. У наведеній нами реакції автокаталізаторами є іони Mn2+.
Наважку оксалатової кислоти для титрування за методом окремих наважок обчислюють, виходячи із рівності кількостей моль-еквівалентів реагуючих речовин.
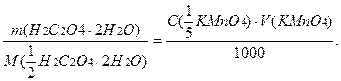
m(H2C2O4∙2H2O)= 
де 20 - приблизний об’єм розчину KMnO4 в мл, витрачений на титрування при користуванні бюреткою місткістю 50,0 мл; 63,04- молярна маса еквівалента H2C2O4·2H2O=M(1/2 H2C2O4·2H2O).
Хід аналізу. Наважку оксалатової кислоти близько 0,126 г розчиняють у 40см3 води, добавляють 10 мл розчину H2SO4 (1:4), нагрівають суміш до 70-800C. Титрують гарячий розчин розчином KMnO4 до появи рожевого забарвлення. Титрування повторюють 2-3 рази. Обчислюють концентрацію розчину калій перманганату.
C( KMnO4)=
KMnO4)= 
Контрольні питання.
1. Чому неможливо приготувати титрований розчин KMnO4 розчиненням точної наважки KMnO4?
2. Якими домішками може бути забруднений KMnO4?
3. Чому для створення кислого середовища використовують сульфатну кислоту а не хлоридну?
4. Які стандартні речовини можна використовувати для стандартизації KMnO4?
5. Які реакції називають автокаталітичними?
6. Які продукти відновлення перманганат-іонів можуть бути залежно від рН середовища? Напишіть відповідні рівняння реакцій.
Йодометрія
Титриметричні методи, які ґрунтуються на реакціях окиснення іонів I- до I2 або відновлення I2 до I- називають йодометрією. Для всіх йодометричних визначень характерна напівреакція:
I2+2 
 2I- E0=0,54B.
2I- E0=0,54B.
Окисно-відновний потенціал пари I2/2I- свідчить про те, що I2 не є сильним окисником, а I- не є сильним відновником. Вони займають проміжне місце між значеннями потенціалу для типових сильних окисників і відновників. Тому йодометричні методи використовують для визначення і окисників і відновників.
Робочими титрованими розчинами в йодометрії є розчин I2 та розчин натрій тіосульфату.
Титрований розчин йоду можна приготувати, виходячи із точної наважки хімічно чистого кристалічного йоду, який після очистки за допомогою сублімації задовольняє вимогам вихідних речовин. Можна приготувати робочий розчин йоду користуючись продажним препаратом. Однак, у цьому разі титр його визначають титруванням розчином тіосульфату.
Не нашли, что искали? Воспользуйтесь поиском: