
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Потенціометричний метод
Потенціометричний метод аналізу базується на функціональній залежності потенціалу індикаторного електрода від концентрації визначуваного іона. Ця залежність виражається рівнянням Нернста – Тюріна 

 або
або 
де  - потенціал індикаторного електрода, вимірений при певній активності іонів в досліджуваному розчині,
- потенціал індикаторного електрода, вимірений при певній активності іонів в досліджуваному розчині,  - стандартний потенціал даної окисно-відноввної системи, R – універсальна газова стала, Т – абсолютна температура, n – кількість електронів, F – стала Фарадея,
- стандартний потенціал даної окисно-відноввної системи, R – універсальна газова стала, Т – абсолютна температура, n – кількість електронів, F – стала Фарадея,
 (
( ,
,  ) – активність іонів у досліджуваному розчині.
) – активність іонів у досліджуваному розчині.
Так в розведених розчинах активність іонів практично дорівнює концентрації ( ), де f – коефіцієнт активності іонів у розчині.
), де f – коефіцієнт активності іонів у розчині.
Підставивши значення сталих отримують спрощенне рівняння потенціалу

 =
=  або
або 
Існує два варіанта використання цих рівнянь у аналітичній хімії: перший – пряма (абсолютна) потенціометрія - метод аналізу, що базується на виміренні потенціалу індикаторного електрода, зануреного в досліджуваний розчин, та розрахунок концентрації іонів безпосередньо за рівнянням. Цей метод застосовують для визначення концентрації іонів водню, іонів металів, для визначення констант нестійкості (Кнест), дисоціації (Кдис) та добутку розчинності (ДР).
Другим варіантом є потенціометричне титрування, яке грунтується на вимірюванні різниці потенціалів між індикаторним електродом та електродом порівняння в процесі титрування. Як і в об’ємному титруванні поблизу точки еквівалентності відбувається різка зміна концентрації визначуваних іонів, що визиває зміну потенціалу. Точку еквівалентності можна визначити графічно, побудувавши графік залежності Е від V (інтегральна крива, рис а) або ΔЕ/ΔV від V (диференціальна крива, рис б) або за другою ΔЕ/ΔV від V похідною попереднього виразу Δ2Е/ΔV2 від V (рис в), використовують також метод Грана (рис г).
В потенціометричному аналізі розрізняють методи: кислотно-основного, окисно-відновного, осадового та комплексоутворюючого титрування. Для усіх титрувань необхідні два електроди – індикаторний та порівняння. Індикаторним називається електрод, потенціал якого залежить від концентрації визначуваної речовини. Він повинен відповідати наступним вимогам:
· бути оборотнім до визначуваного іона (тобто при зміні концентрації визначуваного іона потенціал повинен змінюватися згідно рівняння Нернста);
· бути хімічно стійким у визначуваному розчині;
відгук повинен бути швидким та відновлювальним.
Е/V ΔЕ/ΔV
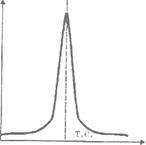

а) б)
Δ2Е/ΔV2 ΔV/ΔЕ

в) г)
Рис. 2 Криві потенціометричного титрування
Останнім часом розроблено багато іонселективних електродів, що дозволило різко збільшити кількість речовин, що аналізуються. Представником іонселективних електродів є скляний електрод, чутливий до іонів водню. Вибір індикаторного електроду зумовлений властивостями аналізуємої речовини. Наприклад, в методі осадження галогенідів солями срібла використовують срібний електрод. При чому потенціал пари Ag+/Ag0 змінюється. Концентрація іонів срібла до точки еквівалентності обумовлена розчинністю осаду, що утворюється (галогеніду срібла) в присутності недотитрованої частини галогеніду, після точки еквівалентності – надлишком розчину срібла.
В кислотно-основному методі як індикаторний використовують водневий електрод, скляний, металокисний, хінгідронний.
В окисно-відновному методі використовують платиновий або графітовий електроди. Потенціал платинового електроду, зануреного в розчин окисно-відновної системи, залежить від співвідношення концентрацій (активностей) окисненої та ввідновленої форм редокс-пари.
Головною вимогою до електрода порівняння є стале значення потенціалу при вимірах. Як електроди порівняння використовують електроди другого роду (каломелевий, хлоридсрібний).
Методи виміру ЕРС поділяіються на компенсаційні та некомпенсаційна. Некомпенсаційний базується на безпосередньому виміренні ЕРС гальванічного елементу або відповідної сили струму. В компенсаційному методі ЕРС досліджуваного елементу компенсується протилежно направленою силою постійного джерела струму.
Для вимірення ЕРС використовують потенціометри: постійного струму (П-4, П-6); високоомні (ППТИ-1, Р-304 та ін.) – використовуються для компенсаційних вимірень, другим типом є лампові потенціометри з високим внутрішнім опором (рН-метри, рН-121, рН-262; іономіри – И-102, ЕВ-74), що дозволяють працювати з різними індикаторними електродами.
Не нашли, что искали? Воспользуйтесь поиском: