
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
теплота, отримана термодинамічною системою, витрачається на зміну її внутрішньої енергії і на виконання нею роботи проти зовнішніх сил.
Для малих приростів величин рівняння (2.2.4) може бути записане в диференціальній формі:
| dQ = dU + dA | (2.2.5) |
3. Теорія теплоємності ідеальних газів
З експериментальних досліджень відомо, що кількість теплоти, необхідна для нагрівання речовини, пропорційна масі речовини т і приросту її температури dT:
| dQ = cmdT, | (2.3.1) |
де с – питома теплоємність речовини, яка залежить від її стану та хімічного складу:
 . .
| (2.3.2) |
Питома теплоємніст ь речовини – це кількість теплоти, необхідна для нагрівання одиниці маси речовини на 1 К.
Здатність речовини нагріватись можна охарактеризувати також за допомогою її молярної теплоємності.
Молярною теплоємністю називається кількість теплоти, необхідна для нагрівання 1 моля речовини на 1 К:
 , ,
| (2.3.3) |
де v = m/M – кількість речовини.
Порівнюючи (2.3.2) і (2.3.3), можна знайти, що
| Ст = с×M. | (2.3.4) |
Знаючи питомі та молярні теплоємності речовини, можна знаходити кількість теплоти Q, необхідну для її нагрівання на D Т:
 ,
,
 ,
,
де D Т = Т 2 - Т 1, тобто різниця кінцевої і початкової температур.
Розглянемо 1 моль ідеального газу. Його внутрішня енергія:
 . .
| (2.3.5) |
Запишемо для нього І принцип термодинаміки в диференціальній формі:
| dQ = dUт + dA | (2.3.6) |
Згідно з (2.3.3), для v = 1:
| dQ = Cm dT. | (2.3.7) |
Згідно з (2.2.1):
| dA = p×dVт | (2.3.8) |
Після підстановки останніх двох співвідношень в (2.3.6) отримаємо:
| Cm dT = dUт + p×dVт. | (2.3.9) |
З цього рівняння можна зробити висновок, що молярна теплоємність ідеального газу Cm суттєво залежить від умов протікання термодинамічного процесу.
Розглянемо 2 специфічні випадки:
а) Ізохорний процес (Vт= const). Для цього випадку введемо позначення:
CV – молярна теплоємність при сталому об’ємі. Оскільки при цьому dVт = 0, то з (2.3.9) знайдемо:
 . .
| (2.3.10) |
або з (2.3.5):
 . .
| (2.3.11) |
б) Ізобарний процес (p = const). Для цього випадку введемо позначення:
Cp – молярна теплоємність при сталому тиску. З (2.3.9) знайдемо:
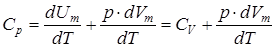 . .
| (2.3.12) |
Запишемо рівняння Менделєєва-Клапейрона для 1 моля
pVm = RT
Продиференціюємо його за умови p = const:
p×dVm = R×dT,
звідки 
Після підстановки в (2.3.12) отримаємо рівняння Майєра:
| Cp = CV + R. | (2.3.13) |
З врахування (2.3.11) можна знайти:
 . .
| (2.3.14) |
Звідси можна знайти коефіцієнт Пуассона (показник адіабати):
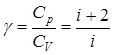 . .
| (2.3.15) |
З формул (2.3.11) і (2.3.14) можна зробити висновок, що молярні теплоємності при сталому тиску і сталому об’ємі визначаються лише числом ступенів свободи молекули газу і не залежать від температури.
Проте цей висновок класичної теорії є справедливим лише для газів з 1-атомними молекулами, які мають 3 ступені свободи. Експериментальні дослідження молекулярних газів виявили, що для них молярна теплоємність є сталою лише в обмежених температурних діапазонах, а на границях цих діапазонів вона змінюється стрибком. Таку поведінку реальних газів дозволяє пояснити квантова теорія. Одним із результатів цієї теорії є те, що число ступенів свободи багатоатомних молекул залежить від температури. Наприклад, для появи коливальних ступенів свободи необхідно нагріти газ до значних температур (тисячі кельвінів). Але на користь наведеної класичної теорії свідчить той факт, що в межах зазначених температурних діапазонів експериментально визначена теплоємність газів досить точно відповідає теоретичним значенням, розрахованим за формулами (2.3.11) і (2.3.14) з цілочисельними значеннями і.
4. Застосування І принципу термодинаміки до ізопроцесів
Під час ізопроцесів основні рівняння, що визначають взаємозв’язок фізичних величин, набувають більш простого вигляду і дозволяють зробити ряд важливих висновків про властивості цих процесів.
1) Ізохорний процес (V = const).
Якщо об’єм газу не змінюється, то dV = 0 і газ не виконує роботи:
 . .
| (2.4.1) |
Тому на основі І принципу термодинаміки можна записати:
 , ,
|
Тобто вся теплота, передана газу, йде на збільшення його внутрішньої енергії. Для одного моля з (2.3.10) знайдемо  , або для довільної маси m газу:
, або для довільної маси m газу:
 . .
| (2.4.2) |
2) Ізобарний процес (р = const).
За цієї умови, згідно з визначенням Ср, приріст кількості теплоти:
 . .
| (2.4.3) |
Використовуючи (2.3.10), для приросту внутрішньої енергії довільної маси газу знайдемо:
 . .
| (2.4.4) |
Робота газу при ізобарному процесі:
 . .
| (2.4.5) |
Для двох станів при р = const можна записати:
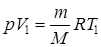 , ,
| |
 . .
|
Звідси

| (2.4.6) |
Приріст роботи:
 . .
| (2.4.7) |
3) Ізотермічний процес (Т = const)
Якщо температура газу не змінюється, то dT = 0 і зміна внутрішньої енергії газу також дорівнює нулю:
 . .
|
Тому, згідно з І принципом термодинаміки, вся теплота, отримана газом, витрачається на виконання роботи проти зовнішніх сил. Використовуючи рівняння Клапейрона-Менделєєва:
 . .
| (2.4.8) |
Оскільки для ізотермічного процесу  , то останнє співвідношення можна записати і через параметри тиску:
, то останнє співвідношення можна записати і через параметри тиску:
 . .
| (2.4.9) |
5. Адіабатний процес
Адіабатним називається термодинамічний процес, який відбувається за відсутності теплообміну термодинамічної системи з навколишнім середовищем.
При цьому
| dQ = 0, | (2.5.1) |
і з І закону термодинаміки можна записати:
| dA = - dU, | (2.5.2) |
тобто зовнішня робота виконується за рахунок зміни внутрішньої енергії системи.
Використовуючи отримані раніше вирази для роботи і внутрішньої енергії газу, останнє рівняння можна переписати у вигляді:
 . .
| (2.5.3) |
Напишемо рівняння стану:
 . .
|
Це ж рівняння напишемо в диференціалах змінних величин:
 . .
| (2.5.4) |
Розділимо (2.5.4) на (2.5.3):

|
Оскільки з рівняння Майєра R = Cp - CV, то звідси:
 , ,
| (2.5.5) |
де g – коефіцієнт Пуассона (див. (2.3.15)):
 . .
| (2.5.6) |
Перетворимо (2.5.5):
 . .
| (2.5.7) |
Після інтегрування та потенціювання знайдемо:
 . .
| (2.5.8) |
Ми отримали рівняння Пуассона, яке визначає взаємозв’язок параметрів під час адіабатного процесу.
Внаслідок того, що число ступенів свободи і може набувати тільки цілочисельних значень 3, 5, 6, 7 і т.д., коефіцієнт Пуассона також може набувати лише певні дискретні значення.
Для 1-атомних газів (наприклад, інертних газів гелію, неону, аргону та ін.) і = 3, g = 1,67;
для 2-атомних газів (наприклад, гази H2, N2, O2 та ін.) і = 5, g = 1,4;
для 3-атомних і багатоатомних газів (СO2, H2O, NН3) і = 6, g = 1,33.
Використовуючи співвідношення (2.5.3), можна визначити роботу газу під час адіабатного процесу:
 , ,
| (2.5.9) |
де Т 1 і Т 2 – початкова і кінцева температури.
| <== предыдущая лекция | | | следующая лекция ==> |
| тиск однаково передається у всі точки об’єму, зайнятого нерухомою рідиною. | | | Статистичне тлумачення ентропії |
Не нашли, что искали? Воспользуйтесь поиском: