
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ВАЛЕНТНОСТИ ПЕРВОГО ПОРЯДКА 3 страница
Еще один пример - Закон Мозли, соотносящий характеристические частоты спектра элементов с их атомными номерами. Сейчас этот закон принимается как “некое доказательство” существования определенного количества электронов в атомах элементов. Те же выводы делаются и на основании оптических спектров. В публикации Национального Бюро Стандартов, озаглавленной Энергетические уровни атома, мы обнаруживаем позитивное утверждение: “Каждый химический элемент может испускать столько атомных спектров, сколько у него электронов”.69 На самом же деле, в обоих случаях эмпирическое свидетельство не говорит ни о чем кроме чисел. И вновь, наблюдения говорят об определенных количествах единиц, но не указывают на природу этих единиц. И до тех пор, пока мы рассуждаем лишь на основании эмпирической информации, это могут быть единицы любого вида, без ограничения.
Отказываясь от электронной теории в связи с этими явлениями, мы не совершаем никакого важного изменения; мы просто изменяем язык, которым выражаем свое понимание явлений. Вместо того чтобы сказать, что натрий имеет 11 электронов, один из которых пребывает в определенной “конфигурации”, на основании наших теоретических выводов мы говорим, что общее число единиц действующего смещения скорости в движениях вращения атома натрия составляет 11 единиц, и что лишь одна из них относится к электрическому (одномерному) вращению. В движениях вращения углерод обладает 6 единицами общего смещения, 4 из которых находятся в электрическом измерении. Из этого следует: в свойствах, обусловленных общим действующим смещением скорости (результирующему общему количеству движения в атоме), число, относящееся к натрию, составляет 11, а к углероду – 6. В тех свойствах, которые определяются смещением в электрическом измерении, соответствующими числами являются 1 для натрия и 4 для углерода.
Перевести образование “ионных соединений” с языка электронной теории на язык СТОВ так же просто. Электронная теория гласит: устойчивость достигается приспособлением к “электронной конфигурации” одного из элементов инертного газа, и что, например, калий и хлор достигают этого за счет передачи одного электрона калия хлору. Таким образом, оба обретают статус элемента инертного газа аргона. СТОВ говорит: в электрическом измерении хлор обладает одной единицей отрицательного смещения скорости вращения (единицей движения во времени). Он может входить в химическое соединение только посредством относительной ориентации, при которой это отрицательное смещение уравновешивается в нулевой точке надлежащим положительным смещением. Калий обладает положительным смещением, величиной в 1 единицу, и соединение одной положительной единицы с отрицательной единицей хлора создает требующийся результирующий общий нуль.
Как показывают вышеприведенные примеры, если рассматриваются лишь “ионные соединения”, СТОВ практически не меняет ничего кроме языка. Но если меняется язык, становится очевидно, что теория, относящаяся к одному ограниченному классу соединений, распространяется и на все реальные химические соединения. На этом основании нет необходимости в изобилии вспомогательных теорий, сформулированных для того, чтобы иметь дело с теми классами соединений, к которым не подходит базовое “ионное” объяснение. Вместо того чтобы прибегать к множеству разных “связей” (ионной связи, ионно-дипольной связи, ковалентной связи, водородной связи, трехэлектронной связи и многочисленным гибридным связям), требующихся для адаптации электронной теории ко многим видам соединений, СТОВ пользуется одними и теми же теоретическими принципами для всех соединений.
В рассмотренных случаях перевод с языка электронной теории на язык СТОВ ведет к значительному прояснению механизма вовлеченных процессов. Если мы перестаем пользоваться электронной теорией, ни одна из ее величин не теряется; на другом языке она переносится в теоретическую структуру СТОВ.
Глава 20
Цепные соединения
Предпринимая общее исследование такой обширной области, как структура органических соединений, очевидно, важно воспользоваться неким видом системы классификации для группирования соединений с похожими характеристиками так, чтобы избежать необходимости иметь дело со многими отдельными веществами. Различие между цепными и кольцевыми соединениями уже упоминалось. Химические свойства цепных соединений определяются преимущественно природой положительных и отрицательных радикалов или атомов, поэтому для этих соединений удобнее установить две отдельные классификации - одна на основе положительного компонента, вторая на основе отрицательного компонента. По сути, классификация, использованная в этой работе, будет соответствовать обычным группированиям, но определяющие критерии не обязательно будут одинаковыми; и в некоторых случаях это будет приводить к расхождению.
Первая (положительная) классификация, которую мы будем рассматривать, включает те соединения, положительные компоненты которых содержат четырехвалентные атомы углерода. Такие соединения называются парафинами. Сначала это название относилось только к углеводородам, но сейчас оно будет распространяться на все цепные соединения четырехвалентного углерода на положительном конце молекулы. Пока нас интересуют цепные соединения, термин “насыщенное соединение” обычно используется, по сути, в том же значении, но такое применение обычно распространяется и на циклические соединения. Во избежание путаницы, он не будет использоваться в этой работе, поскольку на основании установленных нами критериев циклические соединения не могут считаться насыщенными. Парафиновая углеводородная или алкановая цепь – это связь нейтральных групп CH2 с положительным радикалом CH2 на одном конце цепи и отрицательным атомом водорода на другом. Сцепление между атомом водорода и соседней группой CH2 очень сильное, и для большинства целей удобнее рассматривать комбинацию CH2 • H как отрицательный радикал CH3. На этом основании парафиновая углеводородная цепь такова: CH3 • (CH2)n• C3.
Если атом двухвалентного углерода заменяется атомом четырехвалентного углерода, получается олефин (алкин) - цепь, идентичная парафину, за исключением того, что в роли положительного компонента она обладает первичным магнитно-валентным радикалом CH вместо обычно-валентного радикала CH3. Общая формула олефиновых углеводородов или алкинов - CH • (CH2)n• CH3.
В обычной версии этой формулы одна из групп CH2 пребывает вне группы CH, но это не совместимо со структурными принципами, изложенными на предыдущих страницах. На первый взгляд может показаться, что все говорит в пользу традиционной последовательности CH2 • CH. Если убрать все внутренние, магнитно-нейтральные группы, мы приходим к CH • CH3 - теоретической структуре этилена, первого из олефинов, хотя обычно принято считать, что химическое поведение этого соединения пребывает в большей гармонии со структурой CH2 • CH2. Это мнимое противоречие объясняется природой отрицательного радикала CH3. Как уже указывалось, на самом деле этот радикал является CH2 • H. В принципе эту комбинацию можно рассматривать как одну единицу, но если формулу этилена выразить в развернутой форме - CH • CH2 • H, можно видеть, что связь между структурными единицами CH и H теснее, чем между CH2 и H. Да, если молекула этилена цела, группа CH2 находится между CH и H, CH и H являются партнерами в валентном равновесии, а промежуточная группа CH2 нейтральна. Но если молекула достаточно потревожена химическими или другими средствами, единицы СН и Н объединяются, и соединение вступает в последующую реакцию как две молекулы метилена (CH2). Это не такая уж необычная ситуация. Многие наблюдатели сообщали, что при таких обстоятельствах реагирующая молекула не обязательно та же, что молекула в нетронутом состоянии.
Одновалентный атом углерода в роли положительного компонента создает ацетилен. По определению, в класс олефина и ацетилена следует включить все соединения с отмеченными положительными компонентами, а не просто углеводороды. Ныне принятые молекулярные формулы олефинов и ацетиленов должны быть пересмотрены так, чтобы поместить положительно-валентный компонент в конец цепи. Также мы находим, что одновалентная ориентация одиночного атома углерода более устойчива, если он присоединяется к нейтральной группе, у которой углерод имеет ту же валентность, а не к той, у которой валентность углерода равна +2. Независимый атом углерода, составляющий положительный компонент ацетиленов, следует за нейтральной группой CH. Остаток молекулы ацетиленового углеводорода или алкина идентичен соответствующей части молекулы любой из двух других углеводородных цепей, и общая формула представляет собой C • CH • (CH2)n• CH3. Ацетилен похож на этилен тем, что его истинная структура - C • CH • H2, с валентным равновесием между единичными атомами С и Н. Это вынуждает их соединяться, если молекула распадается. Следовательно, химически, соединение действует как две единицы СН.
Прибавление нейтральной группы CH2 к прямой цепи углеводородов не обязательно происходит в существующей цепи. Вместо этого, входящие группы могут вставляться между положительными и отрицательными компонентами любой из нейтральных групп, расширяя группу с СН до CH • CH2 • H2, которую, как установлено раньше, мы можем записать как CH • CH3 или CHCH3. Дальнейшие прибавления могут осуществляться так же, как это делается в основной цепи, - независимым удлинением нейтральной группы. Удлиненная группа известна как ветвь основной цепи, а структуры такого типа называются соединениями с разветвленной цепью.
Разветвление радикала CH3 невозможно, поскольку прибавление группы CH2 создает CH2 • CH2 • H2 или CH2 • CH3, просто удлиняя прямую цепь. Однако группу CH2 можно прибавить к радикалу олефина СН. В этом случае результатом будет CCH3, не эквивалентный расширению цепи. Затем группу CCH3 можно удлинить обычным способом до C • CH2 • CH3 и так далее.
В общепринятых системах терминологии соединения с разветвленной цепью именуются производными соединений с прямой цепью, а положение в цепи указывается числом. Например, 2-метил бутан, 2,3-диметил гексан, и так далее. Дополнительная возможность модификации положительного радикала в олефинах вносит дополнительные вариации в систему, что принимается в расчет с помощью установления нескольких основных классификаций: 1-олефины, 2-олефины, 3-олефины и так далее. Разветвление трактуется так же, как и у парафинов, а соединения получают такие названия как 2-этил-1-гексин, 3,4-диметил-2-пентин и так далее.
На основании структурных связей, установленных в этой работе, названия парафинов в нынешней системе одинаково применимы и к этим соединениям. Однако современные идеи о структуре олефинов и ацетиленов и связанная с ними система терминологии - это результаты электронной теории образования соединений. Результаты СТОВ говорят о необходимости определенной модификации ранее принятых структурных компоновок и изменения названий некоторых соединений. На новой основе олефинам не требуется никакая особая система названий, поскольку система парафинов может распространяться и на олефины. Единственная разница между ними состоит в разветвлении радикала олефина. С этим можно справится, применяя термин 1-алкил, имеющийся, но не употребляющийся в парафиновых соединениях. На этом основании 1-пентин CH • (CH2)3 • CH3, станет просто пентином, 2-пентин CCH3 • (CH2)2 • CH3 становится 1-метил бутаном, а 3-пентин (C • CH2 • CH3) • CH2 • CH3 становится 1-этил пропаном. Тем же способом названия парафинов можно применить к ацетиленам. 1-пентин, C • CH • (CH2)2 • CH3 становится пентином; 2-пентин C • CCH3 • CH2 • CH3 становится 2-метил бутаном и так далее. Пересмотр терминологии желателен не только с точки зрения более точного отражения истинной структуры молекул и не только ради единообразия, он позволяет значительное упрощение.
Информация, полученная в теории, потребует и некоторой модификации традиционных методов представления молекулярной структуры органических соединений. Следует отказаться от так называемых “расширенных формул”, основанных на концепциях электронов и двойных связей (которым, как свидетельствуют наши выводы, нет места в молекуле). По существу точное расположение индивидуальных атомов незначимо. Структурная единица – это скорее группа, чем атом, а положения групп определяются природой и величиной свойств соединения, зависящих от структуры. Поэтому в большинстве обычных случаев адекватно обозначение, которое использовалось до сих пор, - “сжатые” структурные формулы, показывающие лишь состав и последовательность групп.
Обычная компоновка сжатых формул не совсем удовлетворительна, поскольку не указывает на существование положительных и отрицательных валентностей, и, следовательно, не проводит различия между группами одного и того же состава, но противоположной валентности. Например, СН - конечная группа в молекуле парафина - рассматривается всегда одинаковой. Поскольку противоположные валентности играют очень важную роль в молекулярной структуре, желательно, чтобы формула определенно указывала на положительный и отрицательный компоненты соединения. Этого можно достичь без какого-либо серьезного нарушения знакомых паттернов посредством определения положительных и отрицательных компонентов в целом соответственно на правом и левом концах формулы, что является обычной практикой в неорганическом подразделении.
Хотя бы в целях связности было бы логично распространить такую политику на индивидуальные компоненты молекул, и когда-нибудь это должно быть сделано. Представляется, в настоящей работе был бы полезен компромисс между логикой и связностью, чтобы избежать дальнейшего усложнения для читателей, которым уже пришлось бороться с неизбежными отступлениями от традиционной практики. Поэтому для таких первичных единиц как NH2 и OH, а также для таких расширений как NH • CH2 • CH3, O • CH2 • CH3 и так далее знакомые выражения будут сохранены, хотя у большинства отрицательных радикалов это переворачивает обычный положительный порядок на отрицательный. Использование CH3, а не CH2 • H для представления отрицательных метиловых радикалов – тоже отступление от практики связности. Но в этом случае сжатая форма не только более знакома, но и более удобна. Таким образом, полное представление CH2 • H будет использоваться только тогда, когда при обсуждении структуры молекулы этилена необходимо акцентировать истинную природу радикала. В случае отрицательного радикала, аналогичного CH2, использование сжатого выражения не дает значимого преимущества. И этот радикал – комбинация нейтральной группы СН и отрицательного атома водорода – будет показан в его истинной форме - CH • H.
В целях правильного представления молекулярной структуры, очень важно четкое определение нейтральных групп. Если имеются замещения метила, определение может осуществляться пропуском границы деления между компонентами нейтральной группы; например, CH3 • CHCH3 • CH2 • CHCH3 • CH3, 2,4-диметил пентан. Более длинные нейтральные группы можно определить скобками, тогда внутри группы сохраняется положительно-отрицательный порядок. На этом основании формула 3-пропил пентана будет такой: CH3 • CH2 • (CH • CH2 • CH2 • CH3) • CH2 • CH3. Если внутри нейтральных групп потребуется дальнейшее подразделение, разницу между главными группами и подгруппами можно обозначить скобками или другими подходящими символами.
Если включаются два отрицательных компонента, а цепь двойная, подходит привычное выражение (CH3 • CH2)2 • O, если цепи одинаковые. Не одинаковые цепи можно представить выделением двухвалентного компонента и одной из ветвей как отрицательного радикала: CH2 • CH2 • CH2 • (O • CH2 • CH3), или две ветви могут быть показаны на отдельных строчках:
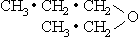
Чтобы представить новые принципы молекулярной структуры, разработанные на основе постулатов СТОВ, в этой работе будут использоваться пересмотренные структурные формулы, описанные в предыдущих параграфах. Для определения положений в цепи мы будем пользоваться нумерацией с положительного конца, а не следовать женевской системе, рассматривающей два конца как взаимозаменяемые. В свете сделанных модификаций разная нумерация необходима для прояснения не только порядка групп, но, в некоторых случаях, и состава группы. Однако пересмотренная нумерация будет использоваться лишь в целях обсуждения; во избежание ненужной путаницы будут сохранены принятые названия соединений. Раньше или позже потребуется полный пересмотр органической номенклатуры.
Небольшие модификации нынешних, структурных идей, требующиеся для олефинов и ацетиленов, обретут большую значимость для диолефинов. Диолефины – это класс соединений, у которых в олефиновую цепь вставляется пара нейтральных групп СН с одновалентным ацетилен углеродом, то есть двухвалентная структура. Соединения C5 этого класса известны как пентадиены. Если группы CH2 заменяются группами CH в третьем и четвертом положениях пентина, результат - CH • CH2 • CH • CH • CH3.
Вместо использования системы нумерации, относящейся к другим членам семьи углеводородов, диолефины нумеруются в соответствии с положениями гипотетических “двойных связей”; такое соединение называется 1,3-пентадиен. Поскольку группа CH3 на отрицательном конце молекулы пентина на самом деле является CH2 • H2, часть CH2 открыта замене на СН. Таким образом, входящие группы СН могут занимать четвертое и пятое положения, создавая соединение CH • CH2 • CH2 • CH • CH • H2, которое сейчас называется 1,4-пентадиен. Другая возможная структура включает удаление атома водорода из положительного радикала СН и расщепление молекулы на две цепи. Если цепи одинаковы, имеется соединение C(CH•CH3H2), которое можно представить и в виде:
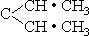
Это 2,3-пентадиен. Разновидность этой структуры удаляет группу CH2 из одной из комбинаций CH3. Это низводит соединение до статуса С4, но его можно восстановить до пентадиена путем вставления группы CH2 в другую ветвь. Это создает то, что называется 1,2-пентадиеном:

С промышленной точки зрения самым важным из диолефинов является изопрен - другое соединение C5, сейчас называемое 2-метил-1,3-бутадиен. Его структура такая же, как у 1,4-пентадиена, за исключением того, что группа CH2, следующая за первой из нейтральных групп СН, убирается из цепи и присоединяется к группе СН как ветвь: CH • CH2 • CCH3 • CH • H.
Азот, стоящий за углеродом в атомных сериях, - следующий самый плодовитый элемент в образовании соединений. Некоторые из “углеродных” соединений, такие как мочевина (одно из первых синтезированных органических соединений), на самом деле, содержат больше азота, чем углерода, но положительным компонентом в этих соединениях является углерод. Удлинение цепи достигается преимущественно путем прибавления групп углерода. Однако имеются и другие соединения, в которых азот играет положительную роль в соединении в целом и в нейтральных группах.
Углеводородам соответствуют гидроазоты. У этих соединений положительным радикалом азота является NH2+, в котором азот обладает усиленной нейтральной валентностью 3. Комбинация этого радикала с отрицательной аминной группой дает гидразин NH2 • NH2. Вставляя одну нейтральную группу NH, мы получаем триазан, NH2 • NH • NH2. Еще одно аналогичное прибавление дает тетразан, NH2 • NH • NH • NH2. Как далеко может заходить этот процесс неясно, поскольку теоретические пределы не установлены, а гидроазоты изучены не так исчерпывающе, как соответствующие соединения углеводородов. В качестве положительного компонента азотные серии, соответствующие ацетиленам, обладают единичным атомом азота с вторичной магнитной валентностью 1. Родительское соединение этой серии – диимид, N • NH2. Прибавление одной нейтральной группы NH дает триазен, N • NH • NH2. С помощью еще одного прибавления мы получаем тетразен, N • NH • NH • NH2. И вновь, дальнейшее удлинение цепи неясно.
В этих азотных соединениях все нейтральные группы имеют набор NH2, у которого азот обладает вторичной магнитной валентностью 1. Теоретически возможна нейтральная группа NH2, основанная на первичной магнитной валентности, но эта группа похожа на радикал амина, за исключением ориентации вращения; ориентация подвергается изменению в соответствии с относительными вероятностями. Радикал амина – более вероятная структура, она препятствует существованию нейтральной группы NH2.
Радикал NH2+ - тоже намного менее вероятная структура, чем радикал амина, у которого азот обладает нормальной отрицательной валентностью, но этот положительный радикал не соперничает с группой амина. Если поблизости имеются единицы NH2, межатомные силы способствуют соединению, и чтобы соединение имело место, некоторые группы должны переориентироваться так, чтобы действовать как положительные компоненты соединений. Радикал NH2+ обладает самыми вероятными положительными ориентациями и берет на себя положительную роль в NH2 • NH2 и подобных комбинациях; положение закрытое для радикала амина. Нейтральная группа NH2 не обладает таким защищенным статусом.
Выше углерода и азота способность образовывать соединения молекулярного типа резко падает, но соответствующие элементы более высоких групп участвуют в нескольких соединениях такой природы. Кремний образует серии гидридов, аналогичных парафиновым углеводородам, с составом SiH3 • (SiH2)n • H, а также несколько соединений, промежуточных между кремниевыми и углеводородными цепями. Типичными примерами последних являются Si3 • CH2 • SiH2 • H, и Si(CH3)3 • CH2 • SiH2 • CH2 • SiH2 • H. Германий образует серии гидридов, известных как германы, они похожи на гидриды кремния или силаны и обладают составом Ge3 • (GeH2)n • H. Известны лишь несколько членов этих серий. Также сообщалось о неустойчивом гидриде олова Sn3 • SnH2 • H2. Следовало ожидать, что три элемента с более высокой валентностью образовывали бы ограниченное число соединений, подобных гидроазотам; и известные соединения такого вида все еще редки. Сообщалось о дифосфене PH2 • PH2 и какодиле As(CH3)2 • As(CH3)2. Поскольку минимальная магнитная валентность фосфора и мышьяка равна 2, эти соединения не могут иметь гидразиновую структуру NH2 • NH • H2, и, возможно, являются соединениями PH • PH2 • H и AsCH3 • As(CH3)2 • CH3. Как указывалось в связи с этиленом и ацетиленом, химическое поведение таких соединений объясняется тенденцией положительного и отрицательного компонентов соединения в целом (таких как PH и Н в дифосфене) объединяться, если соединение нарушается во время химической реакции.
Другие серии соединений молекулярного класса, не относящиеся ни к углероду, ни к азоту, основаны на боре. Поскольку в двумерных соединениях бор действует как элемент Деления IV, он принимает валентность 5, а не обычную валентность 3, которой обладает в соединении, таком как B2O3, где выступает в роли элемента Деления I. Одновалентный радикал на основе валентности 5 был бы BH4 или его эквивалентом, но такой радикал был бы трехмерным и не способным к объединению в двумерную цепь. Следовательно, положительным радикалом в цепи бора является двухвалентная комбинация B3. Как и в углеводородах, отрицательным компонентом молекулы в целом является водород, поэтому требуются два отрицательных атома водорода с валентностью положительного радикала. И вновь, как и в углеводородах, имеется тесная связь между атомами водорода и соседней, нейтральной группой BH, а комбинацию можно рассматривать как отрицательный радикал B3 с валентностью 2. Однако для нынешних целей представляется полезным показывать его в истинной форме - BH • H2.
Магнитные, нейтральные группы соединений бора могут формироваться на основе либо первичной, либо вторичной магнитной валентности, что дает соответственно BH2 и BH. Поскольку это сводит к минимуму число атомов водорода на отрицательном конце молекулы, отрицательный радикал BH • H2 обретает преимущество над BH2 • H2, даже если промежуточные группы являются комбинациями BH2. Присутствие нейтральной группы ВН на отрицательном конце соединения, наряду с некоторыми другими факторами, благоприятствующими преимуществу ВН над BH2, делают структуры ВН более устойчивыми, чем те, в которых нейтральными группами являются BH2.
Основным гидридом бора является диборан B3 • BH • H2. Прибавление нейтральных групп ВН создает серии соединений с составом B3 • (BH)n • H2. Самыми известными из них являются гексаборан, у которого n = 5, и декаборан, у которого n = 9. Замена двух групп BH на пару групп BH2 выливается в серии, обладающие составом B3 • (BH2)2 • (BH)n • H2. Как указывалось в предыдущем параграфе, выше тетраборана, первого члена этих серий (n = 1), соединения менее устойчивы, чем соответствующие соединения всех серий ВН. Во всех соединениях бора замена атомов водорода одновалентными атомами или радикалами возможна так же, как и в углеводородах, но в намного более ограниченной степени.
Как уже отмечалось, распространение характеристик Деления IV на Деление III, способствующее возникновению двумерных комбинаций бора, не относится к соответствующим элементам более высоких групп в любой значимой степени, и они не дублируют серии соединений бора. Имеется неустойчивый гидрид алюминия Al2H6 и соединение Ga2H6, называемое дигаленом. Оба соединения могут быть структурно похожими на диборан, но с небольшим удлинением соединений посредством магнитных, нейтральных групп.
С химической точки зрения молекулярные соединения, образованные элементами, кроме углерода, не так уж интересны, поэтому в любых специализированных учебниках им уделяется лишь небольшое внимание, если уделяется вообще. Однако они важны для нас, поскольку служат подтверждением теоретических выводов, сделанных в связи со структурой углеродных соединений. Соединения азота и бора не только строятся в соответствии с общим, выведенным из теории паттерном и следуют соединениям углерода (то есть, цепи магнитных, нейтральных групп с положительным радикалом на одном конце и отрицательным радикалом на другом), но и подкрепляют теоретические выводы в связи со структурными деталями. Они похожи на углеводородные соединения в тех отношениях, в каких теория находит их похожими, и отличаются от углеводородов в тех отношениях, в каких имеются теоретические различия. Например, все три элемента образуют двухвалентные (CH2 и так далее) и одновалентные (СН и так далее) магнитные, нейтральные группы (за исключением NH2, отсутствие которого объяснялось) потому, что эти магнитные валентности являются свойствами группы элементов (2А), которой принадлежат все три элемента. С другой стороны, радикалы в конечных положениях не одинаковы потому, что электрические валентности, связанные с этими радикалами и обуславливающие свойства каждого из трех элементов, разные.
Вторая система классификации органических цепных соединений, основанная на природе отрицательных компонентов, является не альтернативой, а параллельной системой. Соединение классифицировалось как спирт потому, что природа его отрицательного компонента принадлежит одной из категорий, установленных на основе идентификации положительного компонента. Для упрощения представления предшествующее обсуждение в основном сосредотачивалось на углеводородах, но все утверждения, сделанные в связи с соединениями, у которых отрицательным компонентом является водород (один или в соединении с CH2, и с отрицательным радикалом CH3), одинаково справедливы и для тех соединений, у которых водород заменен эквивалентным, отрицательным атомом или группой. Поэтому у нас есть парафиновые спирты, олефиновые спирты (ненасыщенные) и так далее.
Не нашли, что искали? Воспользуйтесь поиском: