
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ.
|
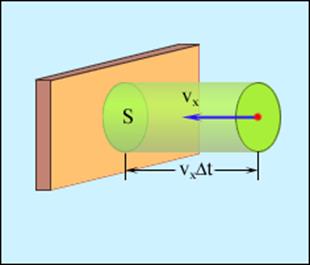
| Рис. 85. Определение числа столкновений молекул с площадкой S. |
Молекулы газа, в состоянии хаотического движения, непрерывно сталкиваются друг с другом. Между двумя столкновениями молекулы проходят путь l, который называется длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, но так как мы имеем дело с огромным числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул < l >.
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d. Он зависит от скорости сталкивающихся молекул, т. е. от температуры газа (несколько уменьшается с ростом температуры). За 1 с молекула проходит путь, равный средней арифметической скорости <vар.>, и если <z> - среднее число столкновений, испытываемых одной молекулой за 1 с, то средняя длина свободного пробега <l> = <vар.>/<z>. (11.43.)
Среднее число столкновений за 1 с равно числу молекул в объеме цилиндра радиусом d.
<z> = nV, (11.44.)
где n - концентрация молекул, а
V = pd2.<vар.>. (11.45.)
Эта молекула столкнется только с теми молекулами, центры которых находятся на расстояниях, равных или меньших d, т. е. лежат внутри «ломаного» цилиндра радиусом d. Среднее число столкновений за 1 с равно числу молекул в объеме «ломаного» цилиндра V. Таким образом, среднее число столкновений
<z> = npd2.<vар.>. (11.46.)
Расчеты показывают, что при учете движения других молекул
<z> = Ö2. pd2.<vар.>. (11.47.)
Тогда средняя длина свободного пробега
<l> = 1/(Ö2. pd2.<vар.>.) (11.48.)
т.е. <l> обратно пропорционально концентрации n молекул. При постоянной температуре n пропорционально давлению р.
<l1>/<l2> = n2/n1 = p2/p1. (11.49.)
ПРИМЕР № 1. В сосуде объемом V находится кислород массой m при давлении P. Определить среднюю квадратичную скорость молекул газа и плотность газа.
Дано Решение:
| V |
| P |
 =? =?
|
| ρ=? |

Выразим из уравнения Менделеева-Клапейрона
 =>
=>  тогда:
тогда: 
Плотность газа: 
Ответ:  ;
; 
Не нашли, что искали? Воспользуйтесь поиском: