
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ.
В качестве модели твердого тела рассмотрим правильно построенную кристаллическую решетку, в узлах которой частицы (атомы, ионы, молекулы), принимаемые за материальные точки, колеблются около своих положений равновесия — узлов решетки — в трех взаимно перпендикулярных направлениях. Таким образом, каждой составляющей кристаллическую решетку частице приписывается три колебательных степени свободы, каждая из которых, согласно закону равнораспределения энергии по степеням свободы, обладает энергией kT.
Каждая частица кристаллической решетки имеет три колебательных степени свободы, каждая из которых, обладает энергией kT. Внутренняя энергия 1 моля твердого тела Uм = 3NAkT = 3RT, (17.22.)
где NA - постоянная Авогадро; Nak = R.
Закон Дюлонга-Пти.
Молярная теплоемкость твердого тела Cv = dUм/dT =3R=25 Дж/(м.К), (17.23.)
т.е. теплоемкость химически чистых тел в кристаллическом состоянии одинакова и не зависит от температуры.
Если твердое тело является химическим соединением (например, NaCl), то число частиц в моле не равно постоянной Авогадро, а равно nNA, где n — число атомов в молекуле (для NaCl число частиц в моле равно 2NA, так, в одном моле NaCl содержится NA атомов Na и NA атомов Cl). Таким образом, молярная теплоемкость твердых химических соединений т. е. равна сумме атомных теплоемкостей элементов, составляющих это соединение.
Опытные данные для многих веществ закон Дюлонга и Пти выполняется с довольно хорошим приближением, хотя некоторые вещества (С, Be, В) имеют значительные отклонения от вычисленных теплоемкостей. Кроме того, так же как и в случае газов, опыты по измерению теплоемкости твердых тел при низких температурах показали, что она зависит от температуры (рис.). Вблизи нуля кельвин теплоемкость тел пропорциональна Т3, и только при достаточно высоких температурах, характерных для каждого вещества, выполняется условие. Алмаз, например, имеет теплоемкость, равную 3 R при1800 К! Однако для большинства твердых тел комнатная температура является уже достаточно высокой.
17.14. Испарение, сублимация, плавление и кристаллизация. Аморфные тела
Как в жидкостях, так и в твердых телах всегда имеется некоторое число молекул, энергия которых достаточна для преодоления притяжения к другим молекулам и которые способны оторваться от поверхности жидкости или твердого тела и перейти в окружающее их пространство. Этот процесс для жидкости называется испарением (или парообразованием), для твердых тел — сублимацией (или возгонкой).
Испарение жидкостей идет при любой температуре, но его интенсивность с повышением температуры возрастает. Наряду с процессом испарения происходит компенсирующий его процесс конденсации пара в жидкость. Если число молекул, покидающих жидкость за единицу времени через единицу поверхности, равно числу молекул, переходящих из пара в жидкость, то наступает динамическое равновесие между процессами испарения и конденсации. Пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
Для большинства твердых тел процесс сублимации при обычных температурах незначителен и давление пара над поверхностью твердого тела мало; оно повышается с повышением температуры. Интенсивно сублимируют такие вещества, как нафталин, камфора, что обнаруживается по резкому, свойственному им запаху. Особенно интенсивно сублимация происходит в вакууме — этим пользуются для изготовления зеркал. Известный пример сублимации — превращение льда в пар — мокрое белье высыхает на морозе.
Если твердое тело нагревать, то его внутренняя энергия (складывается из энергии колебаний частиц в узлах решетки и энергии взаимодействия этих частиц) возрастает. При повышении температуры амплитуда колебаний частиц увеличивается до тех пор, пока кристаллическая решетка не разрушится, — твердое тело плавится. По мере сообщения твердому телу теплоты его температура повышается, а при температуре плавления Tпл, начинается переход тела из твердого состояния в жидкое. Температура Tпл остается постоянной до тех пор, пока весь кристалл не расплавится, и только тогда температура жидкости вновь начнет повышаться.
Нагревание твердого тела до Tпл еще не переводит его в жидкое состояние, поскольку энергия частиц вещества должна быть достаточной для разрушения кристаллической решетки. В процессе плавления теплота, сообщаемая веществу, идет на совершение работы по разрушению кристаллической решетки, а поэтому Tпл = const до расплавления всего кристалла. Затем подводимая теплота пойдет опять-таки на увеличение энергии частиц жидкости и ее температура начнет повышаться. Количество теплоты, необходимое для расплавления 1 кг вещества, называется удельной теплотой плавления.
Если жидкость охлаждать, то процесс протекает в обратном направлении; Q' — количество теплоты, отдаваемое телом при кристаллизации): сначала температура жидкости понижается, затем при постоянной температуре, равной T пл, начинается кристаллизация, после ее завершения температура кристалла начнет понижаться. Для кристаллизации вещества необходимо наличие так называемых центров кристаллизации — кристаллических зародышей, которыми могут быть не только кристаллики образующегося вещества, но и примеси, а также пыль, сажа и т. д. Отсутствие центров кристаллизации в чистой жидкости затрудняет образование микроскопических кристалликов, и вещество, оставаясь в жидком состоянии, охлаждается до температуры, меньшей температуры кристаллизации, при этом образуется переохлажденная жидкость. При сильном переохлаждении начинается спонтанное образование центров кристаллизации и вещество кристаллизуется довольно быстро.
Обычно переохлаждение расплава происходит от долей до десятков градусов, но для ряда веществ может достигать сотен градусов. Из-за большой вязкости сильно переохлажденные жидкости теряют текучесть, сохраняя, как в твердые тела, свою форму. Эти тела получили название аморфных твердых тел; к ним относятся смолы, мех, сургуч, стекло. Аморфные тела, являясь, таким образом, переохлажденными жидкостями, изотропны, т. е. их свойства во всех направлениях одинаковы; для них, как и для жидкостей, характерен ближний, порядок в расположении частиц; в них в отличие от жидкостей подвижность частиц довольно мала. Особенностью аморфных тел является отсутствие у них определенной точки плавления, т. е. невозможно указать определенную температуру, выше которой можно было бы констатировать жидкое состояние, а ниже — твердое. Из опыта известно, что в аморфных телах со временем может наблюдаться процесс кристаллизации, например в стекле появляются кристаллики; оно, теряя прозрачность, начинает мутнеть и превращаться в поликристаллическое тело.
В последнее время широкое распространение в народном хозяйстве получили полимеры — органические аморфные тела, молекулы которых состоят из большого числа одинаковых длинных молекулярных цепочек, соединенных химическими (валентными) связями. К полимерам относятся как естественные (крахмал, белок, каучук, клетчатка и др.), так и искусственные (пластмасса, резина, полистирол, лавсан, капрон и др.) органические вещества. Полимерам присущи прочность и эластичность; некоторые полимеры выдерживают растяжение, в 5—10 раз превышающее их первоначальную длину. Это объясняется тем, что длинные молекулярные цепочки могут при деформации либо сворачиваться в плотные клубки, либо вытягиваться в прямые линии. Эластичность полимеров проявляется только в определенном интервале температур, ниже которого они становятся твердыми и хрупкими, а выше — пластичными. Хотя синтетических полимерных материалов создано очень много (искусственные волокна, заменители кожи, строительные материалы, заменители металлов и др.), но теория полимеров до настоящего времени полностью не разработана. Ее развитие определяется запросами современной техники, требующей синтеза полимеров с заранее заданными свойствами.
ФАЗОВЫЕ ПЕРЕХОДЫ.

Рис. 124. Водяной пар (1) и вода (2). Молекулы воды увеличены примерно в 5·107 раз.
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества. Если, например, в закрытом сосуде находится вода, то эта система является двухфазной: жидкая фаза — вода; газообразная фаза — смесь воздуха с водяными парами. Если в воду бросить кусочки льда, то эта система станет трехфазной, в которой лед является твердой фазой. Часто понятие «фаза» употребляется в смысле агрегатного состояния, однако надо учитывать, что оно шире, чем понятие «агрегатное состояние». В пределах одного агрегатного состояния вещество может находиться в нескольких фазах, отличающихся по своим свойствам, составу и строению (лед, например, встречается в пяти различных модификациях — фазах). Переход вещества из одной фазы в другую — фазовый переход — всегда связан с качественными изменениями свойств вещества. Примером фазового перехода могут служить изменения агрегатного состояния вещества или переходы, связанные с изменениями в составе, строении и свойствах вещества (например, переход кристаллического вещества из одной модификации в другую).

|
| Рис. 125 Пример ближнего порядка молекул жидкости и дальнего порядка молекул кристаллического вещества: 1 – вода; 2 – лед. |
Различают фазовые переходы двух родов. Фазовый переход I рода (например, плавление, кристаллизация и т. д.) сопровождается поглощением или выделением теплоты, называемой теплотой фазового перехода. Фазовые переходы I рода характеризуются постоянством температуры, изменениями энтропии и объема. Объяснение этому можно дать следующим образом. Например, при плавлении телу нужно сообщить некоторое количество теплоты, чтобы вызвать разрушение кристаллической решетки. Подводимая при плавлении теплота идет не на нагрев тела, а на разрыв межатомных связей, поэтому плавление протекает при постоянной температуре. В подобных переходах — из более упорядоченного кристаллического состояния в менее упорядоченное жидкое состояние — степень беспорядка увеличивается, т. е., согласно второму началу термодинамики, этот процесс связан с возрастанием энтропии системы. Если переход происходит в обратном направлении (кристаллизация), то система теплоту выделяет.
Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объема, называются фазовыми переходами II рода. Эти переходы характеризуются постоянством объема и энтропии, но скачкообразным изменением теплоемкости. Общая трактовка фазовых переходов II рода предложена академиком Л. Д. Ландау (1908—1968). Согласно этой трактовке, фазовые переходы II рода связаны с изменением симметрии: выше точки перехода система, как правило, обладает более высокой симметрией, чем ниже точки перехода. Примерами фазовых переходов II рода являются: переход ферромагнитных веществ (железа, никеля) при определенных давлении в температуре в парамагнитное состояние; переход металлов и некоторых сплавов при температуре, близкой к 0 К, в сверхпроводящее состояние, характеризуемое скачкообразным уменьшением электрического сопротивления до нуля; превращение обыкновенного жидкого гелия (гелия I) при Т =2,9 К в другую жидкую модификацию (гелий II), обладающую свойствами сверхтекучести.
17.16. Диаграмма состояния. Тройная точка
Если система является однокомпонентной, т. е. состоящей из химически однородного вещества или его соединения, то понятие фазы совпадает с понятием агрегатного состояния. Согласно § 60, одно и то же вещество в зависимости от соотношения между удвоенной средней энергией, приходящейся на одну степень свободы хаотического (теплового) движения молекул, и наименьшей потенциальной энергией взаимодействия молекул может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Это соотношение, в свою очередь, определяется внешними условиями — температурой и давлением. Следовательно, фазовые превращения также определяются изменениями температуры и давления.
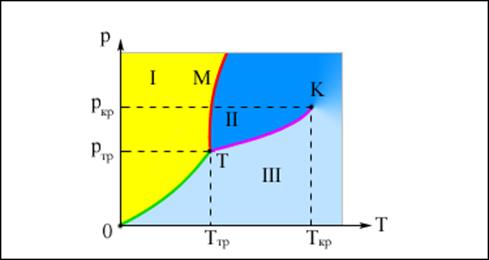
|
| Рис. 126. Типичная фазовая диаграмма вещества. K – критическая точка, T – тройная точка. Область I – твердое тело, область II – жидкость, область III – газообразное вещество. |
Для наглядного изображения фазовых превращений используется диаграмма состояния (рис.), на которой в координатах р,Т задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС), разделяющих поле диаграммы на три области, соответствующие условиям существования твердой (ТТ), жидкой (Ж) и газообразной (Г) фаз. Кривые на диаграмме называются кривыми фазового равновесия, каждая точка на них соответствует условиям равновесия двух сосуществующих фаз: КП — твердого тела и жидкости, КИ—жидкости и газа, КС—твердого тела и газа.
Точка, в которой пересекаются эти кривые и которая, следовательно, определяет условия (температуру Ттр и соответствующее ей равновесное давление р тр) одновременного равновесного сосуществования трех фаз вещества, называется тройной точкой. Каждое вещество имеет только одну тройную точку. Тройная точка воды соответствует температуре 273,16 К (или температуре 0,01°С по шкале Цельсия) и является основной реперной точкой для построения термодинамической температурной шкалы.
Различаются фазовые переходы двух родов. Фазовый переход первого рода сопровождается поглощением или выделением теплоты, называемой теплотой фазового перехода (ВОДА — ЛЕД). Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объема, называются фазовыми переходами второго рода (ферромагнетики в точке Кюри). При переходах второго рода внутренняя энергия вещества и его объем не изменяются в точке перехода и, следовательно, не происходит выделения или поглощения скрытой теплоты.
Оглавление. МЕХАНИКА. (для 3-х семестров).
D:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifЛекция № 1. ВВЕДЕНИЕ В ЛАБОРАТОРНЫЙ ПРАКТИКУМ.
1. Измерения и погрешности измерений.
2. Расчет погрешностей прямых измерений.
3. Обработка результатов косвенных измерений.
D:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifЛекция № 2.
2.1. ВВЕДЕНИЕ.
2.2. Единицы физических величин.
2.3. ЭЛЕМЕНТЫ ВЕКТОРНОЙ АЛГЕБРЫ.
2.4. ПРОИЗВОДНАЯ И ИНТЕГРАЛ.
2.5. МЕХАНИКА.
2.6. ПРОСТРАНСТВО И ВРЕМЯ.
2.7. МОДЕЛИ В МЕХАНИКЕ.
2.8. ПОСТУПАТЕЛЬНОЕ И ВРАЩАТЕЛЬНОЕ ДВИЖЕНИЯ.
2.9. СТЕПЕНИ СВОБОДЫ. ПЕРЕМЕЩЕНИЕ.
ПУТЬ. ТРАЕКТОРИЯ.
D:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifЛекция № 3.
3.1. СКОРОСТЬ.
3.2. УСКОРЕНИЕ
3.3. УРАВНЕНИЯ ДВИЖЕНИЯ.
3.4. СВОБОДНОЕ ПАДЕНИЕ ТЕЛ.
3.5. ДВИЖЕНИЕ ПО ОКРУЖНОСТИ.
3.6. ВРАЩЕНИЕ ТВЕРДОГО ТЕЛА ВОКРУГ НЕПОДВИЖНОЙ ОСИ.
3.7. УГЛОВАЯ СКОРОСТЬ И УГЛОВОЕ УСКОРЕНИЕ.
D:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifЛекция № 4.
4.1. ДИНАМИКА МАТЕРИАЛЬНОЙ ТОЧКИ.
4.2. ЗАКОНЫ НЬЮТОНА.
4.3. ТОЧКИ ПРИЛОЖЕНИЯ СИЛ.
4.4. СИЛЫ ТРЕНИЯ.
4.5. ЗАКОН ВСЕМИРНОГО ТЯГОТЕНИЯ.
4.6. СИЛА ТЯЖЕСТИ И ВЕС.
D:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifЛекция № 5.
5.1. ОСНОВНЫЕ ПОНЯТИЯ О СИСТЕМЕ ТЕЛ.
5.2. ДЕФОРМАЦИИ ТВЕРДОГО ТЕЛА.
5.3. ЗАКОН ГУКА. (УПРУГИЕ СИЛЫ).
5.4. ДЕФОРМАЦИИ СДВИГА.
5.5. ДЕФОРМАЦИИ КРУЧЕНИЯ.
5.6. ИМПУЛЬС.
5.7. АБСОЛЮТНО УПРУГИЙ УДАР.
5.8. АБСОЛЮТНО НЕУПРУГИЙ УДАР.
5.9. ДВИЖЕНИЕ ТЕЛА С ПЕРЕМЕННОЙ МАССОЙ.
D:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifЛекция № 6.
6.1. ЭЛЕМЕНТЫ ГИДРОСТАТИКИ. ЗАКОН ПАСКАЛЯ.D:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\buttonModel_h.gif
6.2. ЗАКОН АРХИМЕДА.
6.3. ГИДРАВЛИЧЕСКИЕ МАШИНЫ.
6.4. УРАВНЕНИЕ НЕРАЗРЫВНОСТИ.
6.5. УРАВНЕНИЕ БЕРНУЛЛИ И ЕГО СЛЕДСТВИЯ.
D:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Bwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 2\design\images\Bwd_h.gifЛекция № 7.
7.1. ЭНЕРГИЯ. РАБОТА.
7.2. КИНЕТИЧЕСКАЯ ЭНЕРГИЯ.
7.3. ПОТЕНЦИАЛЬНАЯ ЭНЕРГИЯ.
7.4. ЗАКОН СОХРАНЕНИЯ МЕХАНИЧЕСКОЙ ЭНЕРГИИ.
Лекция № 8.
8.1. МОМЕНТ ИНЕРЦИИ.
8.2. МОМЕНТЫ ИНЕРЦИИ НЕКОТОРЫХ ТЕЛ.
8.3. ТЕОРЕМА ШТЕЙНЕРА.
8.4. КИНЕТИЧЕСКАЯ ЭНЕРГИЯ ВРАЩЕНИЯ.
8.5. МОМЕНТ СИЛЫ.
8.6. РАБОТА ПРИ ВРАЩЕНИИ ТВЕРДОГО ТЕЛА.
8.7. МОМЕНТ ИМПУЛЬСА. ЗАКОН СОХРАНЕНИЯ.
8.8. СРАВНЕНИЕ ВЕЛИЧИН И УРАВНЕНИЙ
ПОСТУПАТЕЛЬНОГО И ВРАШАТЕЛЬНОГО ДВИЖЕНИЙ.
8.9. Свободные оси. Гироскоп.
8.10 РАБОТА В ПОЛЕ ТЯГОТЕНИЯ.
8.11. ПОТЕНЦИАЛ ПОЛЯ ТЯГОТЕНИЯ.
8.12. КОСМИЧЕСКИЕ СКОРОСТИ.
8.13. ГАРМОНИЧЕСКИЕ КОЛЕБАНИЯ.
8.14. ПРУЖИННЫЙ МАЯТНИК.
8.15. ФИЗИЧЕСКИЙ МАЯТНИК.
8.16. МАТЕМАТИЧЕСКИЙ МАЯТНИК.
8.17. РЕЗОНАНС.
8.18. ПРЕВРАЩЕНИЯ ЭНЕРГИИ ПРИ СВОБОДНЫХ КОЛЕБАНИЯХ.
Лекция № 9.
9.1. НЕИНЕРЦИАЛЬНЫЕ СИСТЕМЫ ОТСЧЕТА.
.9.2. СИЛЫ ИНЕРЦИИ.
9.3. ПРИНЦИП ЭКВИВАЛЕНТНОСТИ ЭЙНШТЕЙНА.
9.4. ПРЕОБРАЗОВАНИЯ ГАЛИЛЕЯ.
9.5. МЕХАНИЧЕСКИЙ ПРИНЦИП ОТНОСИТЕЛЬНОСТИ.
9.6. ПОСТУЛАТЫ СПЕЦИАЛЬНОЙ ТЕОРИИ ОТНОСИТЕЛЬНОСТИ.
9.7. ПРЕОБРАЗОВАНИЯ ЛОРЕНЦА.
9.8. СЛЕДСТВИЯ ИЗ ПРЕОБРАЗОВАНИЙ ЛОРЕНЦА.
9.9. ИНТЕРВАЛ МЕЖДУ СОБЫТИЯМИ.
9.10. ОСНОВНОЙ ЗАКОН РЕЛЯТИВИСТСКОЙ ДИНАМИКИ.
9.11. ЗАКОН ВЗАИМОСВЯЗИ МАССЫ И ЭНЕРГИИ.
9.12. D:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Fwd_h.gifD:\Program Files\Physicon\Open Physics 2.5 part 1\design\images\Bwd_h.gifОПЫТ МАЙКЕЛЬСОНА- МОРЛИ.
МОЛЕКУЛЯРНАЯ ФИЗИКА.
Лекция № 10.
10.1. ЗАДАЧИ МОЛЕКУЛЯРНОЙ ФИЗИКИ.
10.2. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ.
10.3. ИДЕАЛЬНЫЙ ГАЗ.
10.4. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ.
10.5. АГРЕГАТНЫЕ СОСТОЯНИЯ ВЕЩЕСТВА.
10.6. УРАВНЕНИЕ КЛАПЕЙРОНА-МЕНДЕЛЕЕВА.
10.7. ГАЗОВЫЕ ЗАКОНЫ.
Лекция № 11.
11.1. ОСНОВНОЕ УРАВНЕНИЕ.
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ.
11.2.СКОРОСТИ МОЛЕКУЛ ГАЗА.
11.3. ЭНЕРГИЯ ПОСТУПАТЕЛЬНОГО ДВИЖЕНИЯ МОЛЕКУЛ ГАЗА,
11.4. ЗАКОН МАКСВЕЛЛА ДЛЯ РАСПРЕДЕЛЕНИЯ.
МОЛЕКУЛ ГАЗА ПО СКОРОСТЯМ И ЭНЕРГИЯМ ТЕПЛОВОГО
ДВИЖЕНИЯ.
11.5. БАРОМЕТРИЧЕСКАЯ ФОРМУЛА.
11.6. РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА.
11.7. СРЕДНЕЕ ЧИСЛО СТОЛКНОВЕНИЙ И
СРЕДНЯЯ ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ.
Лекция № 12.
12.1. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА.
12.2. ЧИСЛО СТЕПЕНЕЙ СВОБОДЫ МОЛЕКУЛЫ.
12.3. ЗАКОН РАВНОМЕРНОГО РАСПРЕДЕЛЕНИЯ ЭНЕРГИИ ПО СТЕПЕНЯМ СВОБОДЫ МОЛЕКУЛ.
12.4. ТЕПЛОЕМКОСТЬ.
12.5. ЯВЛЕНИЯ ПЕРЕНОСА.
12.6. ТЕПЛОПРОВОДНОСТЬ.
12.7. ДИФФУЗИЯ.
12.8. ВНУТРЕННЕЕ ТРЕНИЕ (ВЯЗКОСТЬ).
12.9. Вакуум и его получение. Свойства ультра-разреженных газов.
Лекция № 13.
13.1. ЗАДАЧИ И МЕТОДЫ ТЕРМОДИНАМИКИ.
13.2. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
13.3. РАБОТА ГАЗА ПРИ ИЗМЕНЕНИИ ОБЪЕМА.
13.4. ПРИМЕНЕНИЕ ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ К ИЗОПРОЦЕССАМ.
13.5. АДИАБАТИЧЕСКИЙ ПРОЦЕСС.
13.6. ПОЛИТРОПНЫЙ ПРОЦЕСС.
Лекция № 14.
14.1. ОБРАТИМЫЕ И НЕОБРАТИМЫЕ ПРОЦЕССЫ.
14.2. ЗАКРЫТЫЕ И ОТКРЫТЫЕ ТЕРМОДИНАМИЧЕСКИЕ СИСТЕМЫ.
14.3. КРУГОВОЙ ПРОЦЕСС (ЦИКЛ).
14.4. ЦИКЛ КАРНО.
14.5. ТЕРМОДИНАМИЧЕСКАЯ ТЕМПЕРАТУРА.
14.6. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ.
14.7. ЭНТРОПИЯ, ЕЕ СТАТИСТИЧЕСКОЕ ТОЛКОВАНИЕ И СВЯЗЬ С ТЕРМОДИНАМИЧЕСКОЙ ВЕРОЯТНОСТЬЮ.
14.8. ЭНТРОПИЯ ИДЕАЛЬНОГО ГАЗА.
14.9. ИНФОРМАЦИЯ И ЭНЕРГИЯ
Лекция № 15.
15.1. ТЕПЛОВЫЕ ДВИГАТЕЛИ И ХОЛОДИЛЬНЫЕ МАШИНЫ.
15.2. РЕАЛЬНЫЕ ГАЗЫ. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА.
15.3. ИЗОТЕРМЫ ВАН-ДЕР-ВААЛЬСА.
15.4. ВНУТРЕННЯЯ ЭНЕРГИЯ РЕАЛЬНОГО ГАЗА.
15.5. ЭНТАЛЬПИЯ.
15.6. ЭФФЕКТ ДЖОУЛЯ-ТОМСОНА.
Лекция № 16.
16.1. СОСТОЯНИЯ ВЕЩЕСТВА.
16.2. СЖИЖЕНИЕ ГАЗОВ.
16.3. СВОЙСТВА ЖИДКОСТЕЙ.
16.4. ТЕПЛОВОЕ РАСШИРЕНИЕ ЖИДКОСТИ.
16.5. ТЕПЛОЕМКОСТЬ ЖИДКОСТЕЙ.
16.6. ЯВЛЕНИЯ ПЕРЕНОСА В ЖИДКОСТЯХ.
16.7. ДИФФУЗИЯ.
Лекция № 17.
17.1. ТЕЧЕНИЕ ЖИДКОСТИ.
17.2. ВЯЗКОСТЬ (ВНУТРЕННЕЕ ТРЕНИЕ).
17.3. Метод определения вязкости Стокса.
17.4. ДВИЖЕНИЕ ТЕЛ В ЖИДКОСТЯХ И ГАЗАХ.
17.5. ТЕПЛОПРОВОДНОСТЬ.
17.6. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ.
17.7. СМАЧИВАНИЕ.
17.8. ДАВЛЕНИЕ ПОД ИСКРИВЛЕННОЙ ПОВЕРХНОСТЬЮ ЖИДКОСТИ.
17.9. КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ.
17.10. ТВЕРДЫЕ ТЕЛА. МОНО- И ПОЛИ-КРИСТАЛЛЫ.
17.11. ТИПЫ КРИСТАЛЛИЧЕСКИХ ТВЕРДЫХ ТЕЛ.
17.12. Дефекты в кристаллах.
17.13. ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ.
17.14. Испарение, сублимация, плавление и кристаллизация. Аморфные тела.
17.15.ФАЗОВЫЕ ПЕРЕХОДЫ.
17.16. Диаграммы состояния. Тройная точка.
Не нашли, что искали? Воспользуйтесь поиском: