
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химические уравнения
Химические уравнения показывают вещества, вступающие в химическую реакцию, и образующиеся в результате продукты, а также количественные отношения между всеми участниками реакции. Например, уравнение
2HCl + Ca(OH)2 = CaCl2 + 2H2O
означает, что в реакцию вступают 2 моль соляной кислоты и 1 моль гидроксида кальция; образуются 1 моль хлорида кальция и 2 моль воды, а массы исходных веществ и продуктов реакции удовлетворяют соотношению

Пример 1.8. Серная кислота (H2SO4) реагирует с гидроксидом калия по уравнению
H2SO4 + 2KOH = K2SO4 + 2H2O.
Найти массу гидроксида калия, необходимую для реакции с 20 г серной кислоты, и массы сульфата калия и воды, образующиеся в результате реакции.
Решение. Молярные массы участников реакции составляют соответственно 98 (H2SO4); 56 (KOH); 176 (K2SO4) и 8 (H2O) г/моль. Из уравнения реакции следует, что 1 моль серной кислоты реагирует с 2 моль гидроксида калия или 98 г H2SO4 взаимодействуют с 2 • 56=112 г KOH. Составим пропорцию:
98 г H2SO4 реагируют со 112 г КОН,
20 г - “ - - “ - х г - “ -,
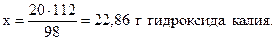
Аналогично в соответствии с уравнением реакции запишем:
из 98 г H2SO4 образуется 176 г K2SO4 ,
из 20 г - “ - - “ - х г - “ -,
 ;
;
из 98 г H2SO4 образуется 36 г Н2O,
из 20 г - “ - - “ - х г - “ –,

Пример 1.9. При взаимодействии серной кислоты и карбоната натрия выделилось 5,0 л углекислого газа (н.у.). Найти массы серной кислоты и карбоната натрия, взятые для реакции, а также массу сульфата натрия и воды, образовавшихся в результате реакции.
Решение. Запишем уравнение реакции:
H2SO4 + Na2CO3 = Na2SO4 + CO2 + H2O.
Из уравнения реакции следует, что в реакцию вступают 1 моль серной кислоты и 1 моль карбоната натрия и образуются по 1 моль сульфата натрия, углекислого газа и воды. Иначе говоря, в реакцию вступают 98 г H2SO4 и 106 г Na2CO3, а образуются 142 г Na2SO4, 44 г CO2 и 18 г H2O. 1 моль углекислого газа, или 44 г, занимает при нормальных условиях объем, равный 22, 4 дм3 (л).
Молярные массы участников реакции составят:

Из уравнения реакции следует:
для получения 22,4 л CO2 необходимо взять 98 г H2SO4,
- “ - - “ - 5 л - “ - - “ - х г - “ -,

Количество углекислого газа можно выразить в граммах:
масса 22,4 л CO2 составляет 44 г,
- “ - 5 л - “ - - “ - х г,
 ,
,
и при последующих вычислениях использовать массу газа, а не объём.
Основываясь на уравнении реакции, найдём массы Na2CO3, Na2SO4 и H2O.
Для получения 44 г CO2 необходимо взять 106 г Na2CO3,
- “ - - “ - 9,82 г - “ - - “ - х г - “ –,

 ;
;
при получении 44 г CO2 образуется 142 г Na2SO4,
- “ - - “ - 9,82 г - “ - - “ - х г - “ –,

 ;
;
при получении 44 г CO2 образуется 18 г H2O,
- “ - - “ - 9,82 г - “ - - “ - х г - “ –,
 .
.
Контрольные задачи
1. Найдите количество вещества азотной кислоты, если её масса составляет 100 г.
Ответ: 1,59 моль.
2. Найдите количество вещества азота, если его объем при нормальных условиях составляет 15 дм3.
Ответ: 0,67 моль.
3. Найдите число формульных единиц гидрокарбоната кальция, число атомов кальция, водорода, углерода и кислорода, содержащихся в 300 г Ca(HCO3)2.
Ответ: 
4. Найдите процентное содержание магния, азота и кислорода в нитрате магния Mg(NO3)2.
Ответ: ωMg=16,2; ωN=18,9;ωО=64,9 %.
5.Найдите массу одной молекулы хлора.
Ответ:1,18.10-22г.
6. Найдите массу гидроксида кальция, необходимую для реакции с 10 г хлороводорода, и массы хлорида кальция и воды, образующиеся в результате реакции
2HCl + Ca(OH)2 = CaCl2 + 2H2O.
Ответ: 
7. Найдите массы оксида кальция, воды и объем углекислого газа, образующиеся при термическом разложении 200 г гидрокарбоната кальция по реакции
Сa(HCO3)2=CaO+H2O+2 CO2.
Ответ: 
8. Найдите массы карбоната натрия и хлорида кальция, необходимые для получения 10 г карбоната кальция по реакции
Na2CO3 + СаCl2 = СаCO3↓ + 2NaCl.
Ответ: 
9. Найдите объём газообразного аммиака (н.у.) и массу серной кислоты, необходимые для получения 50 г сульфата аммония по реакции 2NH3 + H2SO4 =(NH4)2SO4.
Ответ: 
Строение атома
Атом состоит из ядра и электронной оболочки. Ядро состоит из заряженных протонов и незаряженных нейтронов. Число протонов равно порядковому номеру элемента в ПСЭМ. Например, порядковый номер кальция в ПСЭМ равен 20, следовательно, ядро кальция содержит 20 протонов. Число нейтронов определяется как разность между атомной массой изотопа элемента и его порядковым номером. Например, порядковый номер углерода в ПСЭМ равен 6, следовательно, ядро изотопа углерода 12С содержит 12 – 6 = 6 нейтронов, а изотоп углерода 14С содержит 14 – 6 = 8 нейтронов. Атомные массы элементов, приведенные в ПСЭМ, представляют собой средние атомные массы природной смеси различных изотопов элементов, поэтому эти величины не всегда могут быть использованы для нахождения числа нейтронов в ядре атома.
Заряд протона принято считать положительным. Он численно равен заряду электрона, который принято считать отрицательным. Атомы элементов электронейтральны, следовательно, число электронов в атоме равно числу протонов в ядре и равно порядковому номеру элемента в ПСЭМ.
Электроны в атоме образуют электронные уровни и подуровни. Число электронных уровней атома равно номеру периода в ПСЭМ, в котором располагается элемент. Например, элемент калий находится в четвертом периоде, следовательно, его электроны располагаются на 4 электронных уровнях. Электронные уровни могут быть обозначены целыми положительными числами от 1 до 7, что соответствует числу периодов в ПСЭМ. Эти числа носят название главного квантового числа, которое обозначается буквой n. В пределах электронного уровня электроны располагаются на электронных подуровнях. Максимально возможное число электронных подуровней на данном электронном уровне равно номеру уровня, однако в действительности число электронных уровней не превышает четырёх. Например, на 3-м электронном уровне может быть 3 электронных подуровня, а на 5-м и 6-м уровнях имеется только по 4 подуровня. Электронные подуровни обозначаются буквами латинского алфавита s, p, d, f и носят название орбитального или побочного квантового числа. На 1-м электронном уровне имеется только один электронный подуровень – s. Это записывается как 1s. На втором электронном уровне находятся 2 электронных подуровня s и p. Эти подуровни обозначаются как 2s и 2p. Соответственно на 3-м электронном уровне электроны располагаются на трёх подуровнях – 3s, 3p и 3d, а на 4-м – на четырёх подуровнях – 4s, 4p, 4d и 4f. Максимальное количество электронов на s-подуровне составляет 2, на p-подуровне – 6, на d-подуровне – 10, а на f-подуровне – 14. Количество электронов, находящихся на электронном подуровне, обозначается правым верхним индексом. Например, если на р-подуровне 2-го электронного уровня находятся 3 электрона, то это записывается как 2p3, а 7 электронов на d-подуровне 3-го электронного уровня обозначаются как 3d7.
Если на электронном уровне находятся несколько подуровней, то электроны в первую очередь заполняют s-подуровень, затем – p-подуровень, далее – d-подуровень и в последнюю очередь – f-подуровень. Распределение электронов по энергетическим уровням и подуровням называется электронной формулой элемента.
Пример 1.10. Записать электронную формулу атома элемента хлор.
Решение. Порядковый номер хлора в ПСЭМ равен 17, следовательно, ядро атома хлора содержит 17 протонов и нейтральный атом имеет 17 электронов. Хлор находится в 3-м периоде ПСЭМ, следовательно, электроны расположены на трех электронных уровнях. На 1-м уровне имеется только один электронный подуровень s, на котором могут находиться максимально 2 электрона (1s2). На 2-м уровне имеются 2 подуровня – s и p, на которых могут располагаться максимально 2 и 6 электронов, (соответственно (2s2 и 2p6)). На 3-м уровне могут быть 3 подуровня – s, p и d. Но на этом уровне у атома хлора находятся только 17-(2+2+6)=7 электронов. Два из них находятся на s- подуровне(3s2) и 5 – на p-подуровне (3p5). Таким образом, электронная формула хлора будет иметь вид 1s22s22p63s23p5.
Электронные формулы первых 20 элементов ПСЭМ приведены в табл. 1.3.
Отметим, что изложенное применимо в полной мере только к элементам первых трёх периодов ПСЭМ.
Не нашли, что искали? Воспользуйтесь поиском: