
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Второе следствие закона Гесса. Энтальпия химической реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы энтальпий сгорания продуктов реакции.
Энтальпия сгорания вещества В (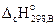 ) – это энтальпия реакции окисления кислородом 1 моль соединения до образования высших оксидов. Например, энтальпия реакции сгорания метанола есть изменение энтальпии следующей реакции:
) – это энтальпия реакции окисления кислородом 1 моль соединения до образования высших оксидов. Например, энтальпия реакции сгорания метанола есть изменение энтальпии следующей реакции:
СН3ОН + 3/2О2 = СО2 + 2Н2О.
Стандартные энтальпии сгорания большого количества органических соединений определены экспериментально и приводятся в справочных изданиях.
Энтальпия химической реакции в общем виде (3.10) определяется по уравнению

(3.12)
Уравнение (3.12) имеет особое значение для органических веществ.
Пример 3.5. Рассчитать стандартную энтальпию реакции
C2H4(г) + Н2(г) = С2Н6(г), если стандартные энтальпии сгорания газообразных этана и этилена составляют -1559,88 и -1410,97 кДж/моль соответственно.
Решение. На основании второго следствия закона Гесса запишем:

Стандартная энтальпия сгорания водорода равна стандартной энтальпии образования воды, т.е.

Подставляя численные значения величин в выражение для стандартной энтальпии реакции, получим
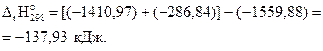

Пример 3.6. Рассчитать стандартную энтальпию реакции образования As2O5, используя следующие данные:
1) 4As(кр)+3О2(г)=2As2O3(кр) – 1313,6 кДж;
2) As2O3(кр)+О2(г)= As2O5(кр) – 311,2 кДж.
Решение: Из уравнения (1) в соответствии с определением энтальпии образования вещества следует, что  составляет половину теплового эффекта этой реакции, т.е. (-1213,6/2)=-606,8 кДж/моль.
составляет половину теплового эффекта этой реакции, т.е. (-1213,6/2)=-606,8 кДж/моль.
Для уравнения (2) на основании 1-го следствия закона Гесса запишем:
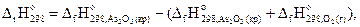
откуда

Не нашли, что искали? Воспользуйтесь поиском: