
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Зависимость теплового эффекта от температуры. Уравнение Кирхгофа
Поскольку по закону Гесса тепловой эффект процесса (реакции) определяется начальным и конечным состоянием системы, очевидно, что для каждого из участников реакции (как исходных веществ, так и продуктов реакции) будут справедливы выражения (1.32) и (1.33). Тогда уравнение зависимости теплового эффекта реакции от температуры можно записать в виде
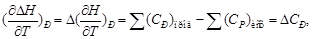 (1.36)
(1.36)
где D CP – разность молярных изобарных теплоемкостей реагентов, взятая с учетом стехиометрических коэффициентов.
Уравнение (1.36) называют уравнением Кирхгофа; оно выражает зависимость теплового эффекта реакции от температуры в дифференциальной форме. Это уравнение строго справедливо лишь при условии, что давление над каждым компонентом при искомой температуре будет таким же, как и при начальной температуре.
Из (1.36) следует, что чувствительность D H к изменению температуры определяется абсолютным значением D CP, а знак температурного коэффициента определяется знаком D CP. При D CP > 0 тепловой эффект реакции растет с повышением температуры; при D CP < 0 – уменьшается и при D CP = 0 не зависит от температуры.
Из (1.34) и (1.35) следует, что для химической реакции
D CP = D a + D bT + D cT 2 + D c′T– 2 + … (1.37)
Подставляя (1.37) в (1.36) и разделяя переменные, в общем виде получим
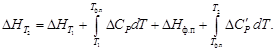 (1.38)
(1.38)
Предполагается, что в рассматриваемом интервале температур T 2 ¸ T 1 в системе происходит фазовое превращение (плавление, парообразование или сублимация), тепловой эффект которого D H ф.п.
Интегрирование уравнения Кирхгофа можно проводить только в том случае, если известна величина 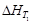 и конкретная зависимость D CP (T) для всех участников реакции.
и конкретная зависимость D CP (T) для всех участников реакции.
Наличие данных о стандартных тепловых эффектах образования или сгорания различных веществ значительно упрощает расчеты. Так, пользуясь величинами 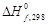 из соответствующих справочных таблиц и уравнениями CP (T) для каждого участника реакции, взяв определенный интеграл от (1.36), получаем
из соответствующих справочных таблиц и уравнениями CP (T) для каждого участника реакции, взяв определенный интеграл от (1.36), получаем
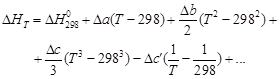 (1.39)
(1.39)
Для газов в сравнительно узком температурном интервале, а для твердых и жидких веществ в достаточно широком, можно считать D CP = const, что дает право пользоваться линейным уравнением
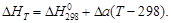 (1.40)
(1.40)
Принимая, что a» D CP ,298, можно также записать
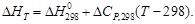 (1.41)
(1.41)
Если значение  очень велико (порядка десятков и сотен тысяч джоулей), то в ряде случаев можно принять D CP = 0, т.е. считать, что
очень велико (порядка десятков и сотен тысяч джоулей), то в ряде случаев можно принять D CP = 0, т.е. считать, что 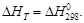 Чаще всего этот случай реализуется при сгорании многих органических веществ, поэтому теплоту сгорания можно считать фактически не зависящей от температуры.
Чаще всего этот случай реализуется при сгорании многих органических веществ, поэтому теплоту сгорания можно считать фактически не зависящей от температуры.
Пример 1.34.
Истинная молярная теплоемкость серебра в интервале температур от 273 до 1234 К выражается уравнением
СP = 23,97 + 5,28×10–3 Т – 0,25×105 Т –2 Дж/(моль∙К).
Вычислить среднюю молярную теплоемкость 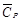 в интервале 298 до 700 К.
в интервале 298 до 700 К.
Решение.
Среднюю теплоемкость в данном интервале температур рассчитывают по уравнению (1.30)
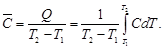
С учетом зависимости истинной теплоемкости от температуры СP = а + bT + c′ . T –2 получим выражение
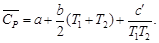
Подставляя коэффициенты a, b, c′ и температуру из условия задачи, получаем
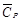 = 23,97 +
= 23,97 + 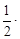 5,28×10–3 (298 + 700) – 0,25×105 /(298×700) = = 23,97 + 2,63 – 0,12 = 26,48 Дж/(моль∙К).
5,28×10–3 (298 + 700) – 0,25×105 /(298×700) = = 23,97 + 2,63 – 0,12 = 26,48 Дж/(моль∙К).
Пример 1.35.
Средняя удельная теплоемкость рутила (TiO2) в интервале от 0 до t °С выражается уравнением
СP = 0,782 + 1,41∙10–4 t – 0,557∙103 t–2 Дж/(г∙°С).
Рассчитать истинную удельную теплоемкость рутила при 500 °С.
Решение.
Среднюю удельную теплоемкость вычисляем по уравнению (1.30) с учетом (1.34):
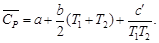
Отсюда
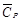 =0,782+2∙1,41∙10–4∙500+0,557∙103∙500–2=
=0,782+2∙1,41∙10–4∙500+0,557∙103∙500–2=
= 0,883 Дж/(г∙°С).
Пример 1.36.
Определить количество теплоты, поглощенной при нагревании 1 кг корунда Al2O3 от 298 до 1000 К, если его молярная теплоемкость в интервале температур 298–1800 К выражается уравнением
СP =114,56 + 12,89·10─3Т-34,31·105 Т─2 Дж(моль·К).
Решение.
Количество теплоты, затраченное на нагревание n моль вещества от Т 1 до Т 2,определяется из соотношения
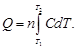
Учитывая, что теплоемкость является функцией температуры, для расчета количества теплоты используем уравнение
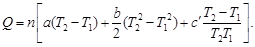
Q = 1000/102 [114,56(1000 – 298) + ½ 12,89 · 10–3(10002–
– 2982) – 34,31.105 (1/298 –1/1000)] = 766 768 Дж = 766,8 кДж.
Пример 1.37.
Молярная теплота испарения метилового спирта при 25 оC составляет 37,4 кДж/моль. Определить теплоту испарения метилового спирта при 50 оC, если молярная теплоемкость жидкого и газообразного метилового спирта соответственно равны 81,6 и 43,9 Дж/(моль∙К). Считать теплоемкость в интервале температур 25-50 оC практически постоянной.
Решение.
Воспользуемся уравнением Кирхгофа в интегральной форме:
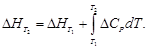
T 1 = 25 + 273 = 298 К, T 2 = 50 + 273 = 323 К
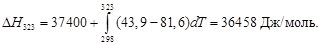
Пример 1.38.
Вычислить тепловой эффект реакции C(т)+CO2(г)=2CO(г) при 500 К, если при стандартных условиях он равен 172,5 кДж, а значения молярных теплоемкостей С, СО, СО2 соответственно следующие:
CP = 17,15 + 4,27×10–3 T – 8,79×105 T –2 Дж/(моль∙К),.
CP = 28,41 + 4,10×10–3 T – 0,46×105 T –2 Дж/(моль∙К),
CP = 44,14 + 9,04×10–3 T – 8,53×105 T –2 Дж/(моль∙К).
Решение.
Воспользуемся уравнением Кирхгофа в интегральной форме:
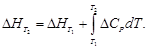
Зависимость CP реагирующих веществ от температуры представлена уравнениями вида CP = a + bT + c′T –2 (для неорганических веществ), поэтому величину D СP рассчитывают по уравнению
DCP = Da + DbT +Dc′T–2.
После подстановки в уравнение Кирхгофа и интегрирования получим
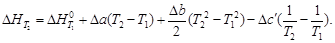
D a = 2·28,41 – 44,14 – 17,15 = -4,47,
D b = (2·4,10 – 9,04 – 4,27)10-3 = -5,1110–3,
D c′ = [–2·0,46 – (-8,53) – (-8,79)]105 = 16,4105.
D H 500 = 172,5×103 – 4,47×(500–298)– 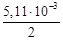 ·(5002–
·(5002–
– 2982) + 16,4×105 (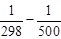 )=173 407 Дж = 173,4 кДж.
)=173 407 Дж = 173,4 кДж.
Пример 1.39.
Вычислить изменение энтальпии при нагревании хлорида серебра от 298 до 1000 К при стандартном давлении и полную энтальпию хлорида серебра при 1000 К. При температуре 728 К происходит плавление хлорида серебра, ∆ Н пл при температуре плавления 13,21 кДж/моль. Зависимость теплоемкости твердого хлорида серебра от температуры взять в Приложении. Теплоемкость жидкого хлорида серебра в интервале температур от 728 до 1000 К остается практически постоянной и равной 66,99 Дж/(моль·К).
Решение.
По уравнению (1.38) определим теплоту нагревания хлорида серебра с учетом единственного фазового превращения в заданном интервале температур:
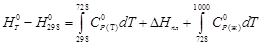 .
.
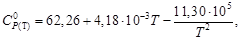
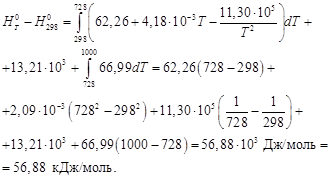
Вычисляем изменение энтальпии, справочные данные берем в приложении 12.
DН0= –126,8 + 56,88 = –69,92 кДж/моль.
Пример 1.40.
Выразить уравнением зависимость теплового эффекта химической реакции
СН3ОН(г)+ 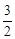 О2(г) = СО2(г) + 2Н2О(г)
О2(г) = СО2(г) + 2Н2О(г)
от температуры, которая справедлива в интервале 298–1000 К.
Тепловой эффект реакции в стандартных условиях  = –675,99 кДж.
= –675,99 кДж.
Решение.
Для получения уравнения зависимости 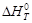 = f (T) воспользуемся выражением (1.39). Справочные данные берем из приложения 12.
= f (T) воспользуемся выражением (1.39). Справочные данные берем из приложения 12.
| Вещество | 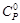 = f (T), Дж/(моль∙К) = f (T), Дж/(моль∙К)
| Температурный интервал, К | |||
| а | b ∙103 | c ′∙10─5 | c ∙106 | ||
| СО2(г) | 44,14 | 9,04 | –8,54 | 298–2500 | |
| Н2О(г) | 30,00 | 10,71 | 0,33 | 273–2500 | |
| СН3ОН(г) | 15,28 | 105,2 | –31,04 | 298–1000 | |
| О2(г) | 31,46 | 3,39 | –3.77 | 273–2000 | |
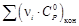
| 104,14 | 32,46 | –7,88 | 298–2500 | |
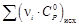
| 62,47 | 110,29 | –5,66 | –31,04 | 298–1000 |
Для данной реакции в интервале температур от 298 до 1000 К уравнение зависимости изменения теплоемкости от температуры будет иметь вид
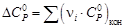 –
– 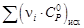 .
.
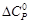 = 31,67 – 77,83∙10─3 Т + 31,04∙10─6 Т 2 – 2,22∙105 Т ─2.
= 31,67 – 77,83∙10─3 Т + 31,04∙10─6 Т 2 – 2,22∙105 Т ─2.
Подставляем под знак интеграла зависимость 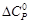 = f (T) и проводим интегрирование в пределах от 298 К до Т, где
= f (T) и проводим интегрирование в пределах от 298 К до Т, где
Т ≤ 1000;  = –675,99 кДж.
= –675,99 кДж.
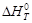 =
=  +
+ 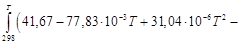

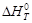 = –675,99∙103 +41,67(Т – 298) – 0,5∙77,83∙10─3(Т 2 – 2982) + +
= –675,99∙103 +41,67(Т – 298) – 0,5∙77,83∙10─3(Т 2 – 2982) + + 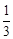 31,04∙10─6(Т 3 – 2983) + 2,22∙105(
31,04∙10─6(Т 3 – 2983) + 2,22∙105( ) = (675,99 –
) = (675,99 –
– 9,44 + 3,46 – 0,27 – 0,74)103 + 41,67 T – 38,91─3 T 2 +
+ 10,35∙10─6 T 3 + 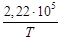 = –682,98∙103 +
= –682,98∙103 +
+ 41,67 T – 38,91∙10─3 T 2 + 10,35∙10─6 T 3 + 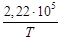 .
.
Таким образом, получено уравнение зависимости теплового эффекта реакции от температуры, справедливое в интервале температур от 298 до 1000 К:
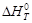 = –682,98∙103 + 41,67 Т – 38,91∙10─3 Т 2 +
= –682,98∙103 + 41,67 Т – 38,91∙10─3 Т 2 +
+ 10,36∙10─6 Т 3 + 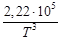 .
.
Пример 1.41.
Обжиг известняка проводится при 1100 °С. Определить расход теплоты на обогрев 1 кг сырья до температуры процесса, если оно состоит в основном из карбоната кальция и поступает в печь обжига при 20 °С.
Решение.
Теплоемкость известняка примем равной теплоемкости СаСО3. Значение средней молярной теплоемкости
СаСО3 рассчитаем по формуле (1.30) с учетом (1.34), значения коэффициентов а, b, c′ возьмем из приложения 12:
а = 104,52; b = 21,92∙10 ─3; c′ = –25,94∙105.
Получаем
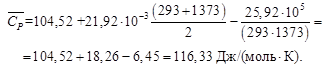 .
.
Удельная теплоемкость известняка
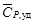 =
= 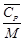 =
= 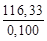 =1163,3 Дж/кг·К,
=1163,3 Дж/кг·К,
где М = 0,100 кг/моль – молярная масса СаСО3.
Тогда расход теплоты
Q = 1000∙1163,3(1373–293) = 1,259∙109 Дж = 1,259 ГДж.
Пример 1.42.
Температура газов пиролиза на выходе из зоны реакции (плазмотрона) равна 1600 °С. Определить необходимый расход воды на закалку (быстрое охлаждение) этих газов в расчете на 1 кг, если их теплоемкость равна 4,15 кДж/(кг∙К), температура на выходе из зоны закалки 150 °С, а температура воды на входе в аппарат 20 °С и на выходе 100 °С. Теплоемкость воды 4,18 кДж/(кг∙К).
Решение.
Используем уравнение теплового баланса.
Приход теплоты с реакционными газами
Q прих = 4,15(1600 – 150) = 6,02∙103 кДж/кг.
Расход теплоты с закалочной водой составляет
Q расх = Х ∙4,18(100 – 20) = X ∙334 кДж,
где Х – расход воды на закалку, кг.
Отсюда, согласно уравнению теплового баланса, имеем
Х = 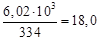 кг.
кг.
Пример 1.43.
1. При экспериментальном определении энтальпии нейтрализации соляной кислоты гидроксидом натрия смешивали растворы HCl и NaOH в прецизионном калориметре, причем температура содержимого калориметра поднялась на 0,2064 °С. Количество воды, выделившееся в результате реакции, равно 3,4075 ммоль. Кроме того, электрические измерения показали, что удельная теплоемкость калориметра и его содержимого равна 938,141 Дж∙°С─1. Вычислить энтальпию нейтрализации на 1 моль соляной кислоты. Необходимо ввести поправку (+649,45 Дж) на 1 моль образовавшейся в конце процесса Н2О к энтальпии смешения растворов HCl и NaOH до того, как прошла реакция.
2. В другом опыте те же исследователи установили, что энтальпия нейтрализации HClO4 в пределах ошибки эксперимента та же, что и для HCl. Однако энтальпия нейтрализации уксусной кислоты гидроксидом натрия равна
–55,727 кДж/моль. Как объяснить тот факт, что энтальпии нейтрализации HCl и HClO4 одинаковы, но отличаются от энтальпии нейтрализации уксусной кислоты?
Решение.
1. ∆ Н = (СР ∆ Т / число молей образовавшейся Н2О) + + поправка = 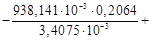
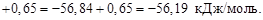
2. HCl и HClO4 – сильные кислоты, они полностью диссоциируют. Разница между наблюдаемыми энтальпиями равна энтальпии диссоциации уксусной кислоты.
Пример 1.44.
Определить тепловой режим реактора синтеза акрилонитрила, если процесс в нем описывается уравнением
С2Н2(г) + НСN(г) ® С3Н3N(ж),
а производительность реактора равна 800 кг акрилонитрила в час. Рассчитать расход воды на охлаждение этого реактора, если она подается в аппарат при 18 °С и отводится из него при 82 °С. Теплоемкость воды 4180 Дж/(кг·К).
Решение.
Температура процесса (82 °С) в данном случае достаточно близка к стандартной (25 °С), поэтому тепловой эффект рассматриваемой реакции можно принять равным стандартному тепловому эффекту и рассчитывать по стандартным теплотам образования реагирующих веществ:
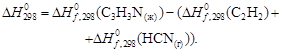
| Вещество, агрегатное состояние | 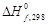 , кДж/моль , кДж/моль
|
| С3Н3N(ж), акрилонитрил | 184,93 |
| С2Н2(г), ацетилен | 226,75 |
| НСN(г), циановодород | 132,00 |
Подставив значения в уравнение, получим
 = 184,93 – (226,75 + 132,00) = –173,82кДж.
= 184,93 – (226,75 + 132,00) = –173,82кДж.
За один пробег реакции образуется 1 моль (0,053 кг) продукта; следовательно, значение теплоты Q уд в расчете на 1кг продукта будет состпвлять
Q уд = 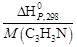 = –
= – 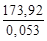 = –3279,62 кДж/кг.
= –3279,62 кДж/кг.
Следовательно, для обеспечения нормальной работы рассматриваемого реактора от него необходимо отводить теплоту:
Q расх = – Q прих = – (–3279,62)∙800 = 2,62∙106 кДж/ч.
Необходимый для этого расход охлаждающей воды в реактор
mв = 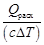 =
= 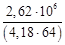 = 9,80∙103 кг/ч,
= 9,80∙103 кг/ч,
здесь с – удельная теплоемкость воды; ∆ Т – повышение температуры воды при прохождении через аппарат,
∆ Т = 82 – 18 = 64 °С.
Пример 1.45.
В теплообменнике, питаемом водой, при нормальном давлении конденсируются пары этанола. Определить расход воды, если производительность аппарата 350 кг/ч этанола, температура воды на входе в аппарат 15 °С, на выходе из него 35 °С, а температура выходящего из аппарата этанола 53 °С. Теплоемкость воды равна 4,184 кДж/(кг∙К). Нормальная теплота испарения этанола Q исп = 42,18 кДж/моль.
Решение.
Воспользуемся уравнением теплового баланса. Приход теплоты в аппарат происходит:
1) за счет конденсации паров этанола:
Q конд = 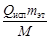 = 42,18∙
= 42,18∙ 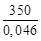 = 3,209∙105 кДж/ч;
= 3,209∙105 кДж/ч;
2) за счет остывания сконденсированного этанола от Т кип до 53 °С:
Q ост = Сm (Т кип – 53) 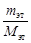 = 111,96∙(78 – 53)∙
= 111,96∙(78 – 53)∙ 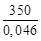 = = 2,130∙107 Дж/ч = =2,130∙104 кДж/ч,
= = 2,130∙107 Дж/ч = =2,130∙104 кДж/ч,
где Сm – молярная теплоемкость этанола, Сm = 111,96 Дж/(моль·К); Мэт – молярная масса этанола, кг/моль.
Расход теплоты из аппарата происходит за счет нагревания воды:
Q нагр = m в С в(Т 2 – Т 1) = m в∙4,184∙(35 – 15) = m в∙83,68 кДж/ч,
где mв – расход воды в аппарате, кг/ч.
Согласно уравнению теплового баланса имеем
Q конд+ Q ост = Q нагр =
= 3,209∙105 + 2,130∙104 = 3,422∙105 = m в∙83,68 кДж/ч.
Отсюда следует
m в= 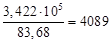 кг/ч.
кг/ч.
Пример 1.46.
Определить максимально возможную температуру продуктов сгорания 2 объемных частей газообразного водорода и 5 объемных частей воздуха (20 об. % кислорода и 80 об. % азота), если температура зажигания равна 25 °С. Какое заключение можно сделать о полученном выражении для теплоемкости 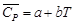 [Дж/(моль∙К)]?
[Дж/(моль∙К)]?
Решение.
Воспользуемся справочными данными (см. приложение 12):
| Вещество | 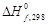 Дж/(моль∙К) Дж/(моль∙К)
| a | b ∙10─3 |
| H2(г) | – | 29,108 | –0,838 |
| O2(г) | – | 25,538 | 13,630 |
| N2(г) | – | 27,021 | 5,920 |
| H2O(г) | –241,81 | 30,247 | 9,834 |
Для реакции
2Н2 (г) + О2 (г) + 4N2 (г) = 2Н2О (г) + 4N2 (г)
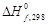 = 2∙(–241,81) = –483,62 кДж.
= 2∙(–241,81) = –483,62 кДж.
Таким образом, 483,62 кДж нагревают 2 моль Н2О(г) и 4 моль N2(г) от температуры 298 Кдо конечной температуры Т 2.
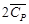 (Н2О (г)) +
(Н2О (г)) + 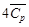 (N2 (г)) = 168,58 + 43,576∙10─3 Т;
(N2 (г)) = 168,58 + 43,576∙10─3 Т;
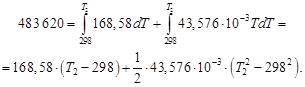
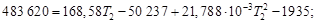
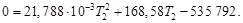
Решая квадратное уравнение и пренебрегая отрицательным корнем, получим Т 2 = 2425 К. Этот результат справедлив, только если уравнение для средней теплоемкости применимо в интервале температур от 298 до 2425 К. При более высоких температурах результаты будут ошибочными.
Пример 1.47.
При получении синтез-газа из гексана основная реакция идет по уравнению
С6Н14(г) + 3О2(г) = 6СО(г) + 7Н2(г).
Пренебрегая побочными явлениями, определить тепловой эффект процесса, если он протекает при 1350 °С в реакторе производительностью 2,50 т/ч синтез-газа состава СО: Н2 = 6: 7 (по объему).
Решение.
По закону Кирхгофа рассчитываем тепловой эффект реакции. Так как средние теплоемкости компонентов системы в заданном интервале температур (до 1623 К) не приводятся, то задачу решаем, пользуясь уравнением (1.39). Для этого воспользуемся справочными данными из приложения 12:
| Компонент i | νi | 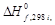 кДж/моль кДж/моль
| ai | bi ∙103 | ci ∙106 | 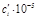
|
| С6Н14(г) | –176,19 | 8,66 | 505,85 | –184,43 | – | |
| О2(г) | 0,00 | 31,46 | 3,39 | – | 3,77 | |
| СО(г) | –110,53 | 29,41 | 4,10 | – | –0,46 | |
| Н2(г) | 0,00 | 27,28 | 3,26 | – | 0,50 | |
| Δ | –495,99 | 258,38 | –468,60 | 184,43 | –10,57 |
Проведем расчет стандартного теплового эффекта реакции (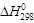 ) и изменения коэффициентов уравнения Кирхгофа (Δ a, Δ b, Δ c, Δ c ′) за один пробег реакции (занесены в последнюю строку таблицы). Подставим результаты вычислений в уравнение (1.39):
) и изменения коэффициентов уравнения Кирхгофа (Δ a, Δ b, Δ c, Δ c ′) за один пробег реакции (занесены в последнюю строку таблицы). Подставим результаты вычислений в уравнение (1.39):
Δ Н 0 Т = –495,99∙103 + 258,38(1623 – 298) +
+ 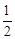 (–464,60∙10─3)(16232 – 2982) + (
(–464,60∙10─3)(16232 – 2982) + (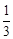 )184,43∙10─6(16233 –
)184,43∙10─6(16233 –
–2983) + (–10,53∙105)(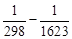 ) =
) =
= –4,9170∙105 Дж/пробег = –491,70 кДж/пробег.
В результате одного пробега реакции образуется 6 моль СО и 7 моль Н2. Это составляет: m = 6∙0,028 + 7∙0,002 = = 0,182 кг синтез-газа указанного в условиях задачи состава. При образовании 1 кг такого газа в реакторе выделяется теплота Q уд:
Qуд = 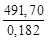 = 2,702∙103 кДж/кг.
= 2,702∙103 кДж/кг.
Следовательно, для нормальной работы рассматриваемой установки необходимо предусмотреть отведение тепла от реактора в количестве
Q = 2,702∙103∙2,50∙103 = 6,755∙106 кДж/ч = 1876 кВт.
Не нашли, что искали? Воспользуйтесь поиском: