
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Химический потенциал
Перейдем к рассмотрению систем, в которых может меняться состав или возможен обмен веществом с окружающей средой. Первый случай имеет место, когда в системе протекают химические реакции. Второй – это случай равновесия двух или большего числа фаз какого-либо вещества. До сих пор мы принимали, что для равновесия необходимо выполнение следующих условий в любой точке системы:
T = const, P = const.
Эти условия являются необходимыми, но недостаточными, если в системе меняется количество вещества или соотношение компонентов.
В системах с переменным составом количество вещества n не является постоянным, а представляет собой новую термодинамическую переменную. Поэтому уравнения для полных дифференциалов функций U, H, F, G должны быть записаны с учетом зависимости этих функций от количества веществ ni. Например, если U = f (S, V, n 1, n 2, ...), то
 (2.61)
(2.61)
Аналогично
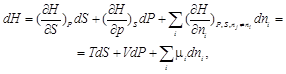 (2.62)
(2.62)
 (2.63)
(2.63)
 (2.64)
(2.64)
где величина
 (2.65)
(2.65)
характеризует приращение соответствующего термодинамического потенциала при изменении количества данного вещества при фиксированных естественных переменных и неизменных количествах остальных веществ. Функцию m называют химическим потенциалом. Подобно тому, как температура является движущей силой при теплопередаче, так и химический потенциал является движущей силой при массопереносе. Как и остальные интенсивные переменные (в соответствующих процессах), химический потенциал вещества по мере протекания процесса выравнивается
и в момент достижения равновесия становится одинаковым во всех сосуществующих фазах.
Самопроизвольные процессы в химических системах при постоянных P и T всегда направлены в сторону уменьшения энергии Гиббса G. В этом случае два первых слагаемых в уравнении (2.64) обратятся в нуль, так как dT = 0,
dP = 0. При этом получаем
 (2.66)
(2.66)
Учитывая (2.35), из уравнения (2.66) получаем
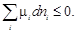 (2.67)
(2.67)
Для равновесной системы соотношение (2.67) имеет вид
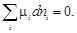 (2.68)
(2.68)
Уравнение (2.68) является общим условием равновесия в системе с переменным количеством компонентов при постоянных давлении и температуре, которое выраженно через химические потенциалы компонентов системы.
Не нашли, что искали? Воспользуйтесь поиском: