
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Задачи для самостоятельного решения 1 страница
2.31. Определить изменение энтальпии, изменение энтропии, изменение внутренней энергии, изменение энергии Гиббса, изменение энергии Гельмгольца (∆ Н 0, ∆ S 0, Δ U 0, Δ G 0, Δ F 0) при одновременном охлаждении от 2000 до 200 К и расширении от 0,5 до 1,35 м3 0,7 моль азота (СV =  ). Энтропия газа в исходном состоянии равна 150 Дж/(моль·К), газ можно считать идеальным.
). Энтропия газа в исходном состоянии равна 150 Дж/(моль·К), газ можно считать идеальным.
2.32. Вычислить изменение энергии Гиббса при сжатии от 1 до 3 атм при температуре 298 К:
1) 1 моль жидкой воды;
2) 1 моль водяного пара (считать идеальным газом).
2.33. Вычислить изменение энергии Гиббса при изменении давления от 1 до 0,01 атм при температуре 298 К:
1) 1 моль жидкого бензола (плотность 0,89 г/см3);
2) 1 моль паров бензола (считать идеальным
газом).
2.34. Изменение энергии Гиббса в результате испарения воды при температуре 95 °C и давлении 1 атм равно 546 Дж/моль. Рассчитать энтропию паров воды при 100 °C, если энтропия жидкой воды равна 87,0 Дж/(моль·К). При каком давлении изменение энергии Гиббса в результате испарения воды будет равно 0 при температуре 95 °C?
2.35. Изменение энергии Гиббса в результате испарения воды при температуре 104 ° Cи давлении 1 атм равно
–437 Дж/моль. Рассчитать энтропию паров воды при 100 °C, если энтропия жидкой воды равна 87,0 Дж/(моль·К). При каком давлении изменение энергии Гиббса в результате испарения воды будет равно 0 при температуре 104 °C?
2.36. Вычислить изменение энергии Гиббса в результате испарения воды при температуре 97 °C и давлении 1 атм, энтропия жидкой и газообразной воды соответственно равна 87,0 и 186,3 Дж/(моль·К). При каком давлении изменение энергии Гиббса в результате испарения воды будет равно 0 при температуре 97 ° C?
2.37. Вычислить изменение энергии Гиббса, сопровождающее изотермическое сжатие 5 л кислорода, взятого при температуре 298 К и давлении от 0,1 до 1 атм.
2.38. Вычислить изменение энергии Гиббса при сжатии 7 г азота при температуре 300 К и давлении от 5,05∙104 до 3,031∙105 Па. (Считать азот идеальным газом.)
2.39. Вычислить изменение энергии Гиббса для процессов:
1) С2Н6О(ж)(Р = 101325 Па) = С2Н6О(г)(Р = 90 900 Па);
2) С2Н6О(ж)(Р = 101325 Па) = С2Н6О(г)(Р = 101 325 Па);
3) С2Н6О(ж)(Р = 101325 Па) = С2Н6О(г)(Р = 111 000 Па).
Если температура кипения 351 К, пары спирта считать идеальным газом. Какие выводы можно сделать о направлении процессов на основании полученных результатов?
2.40. При температуре 268,2 К давление насыщенного пара твердого бензола 2279,8 Па, а над переохлажденным бензолом (жидким) давление 2639,7 Па. Вычислить изменение энергии Гиббса в процессе затвердевания 1 моль переохлажденного бензола при указанной температуре (пары бензола считать идеальным газом).
2.41. Теплота плавления льда при температуре 273 К равна 334,7∙103 Дж/кг. Удельная теплоемкость воды 4,2∙103 Дж/(кг·К), удельная теплоемкость льда 2,02∙103 Дж/(кг·К). Определить изменение энергии Гиббса, изменение энтальпии и изменение энтропии (Δ G, ∆ Н, ∆ S) при превращении 1 моль переохлажденной воды при температуре 268 К в лед.
2.42. Определить изменение энтальпии, изменение энтропии, изменение внутренней энергии, изменение энергии Гиббса, изменение энергии Гельмгольца (∆ Н, ∆ S, Δ U, Δ G, Δ F) для изотермического сжатия 1 моль идеального одноатомного газа при температуре 773 К и давлениях от 5,06∙103 до 1,01∙104 Па.
2.43. В изолированной системе при температуре 273,16 К 1 моль газа обратимо и изотермически расширяется от давления 1,01∙107 до 1,01∙106 Па. Вычислить значения работы, теплоты, изменение энтальпии, изменение энтропии, изменение внутренней энергии, изменение энергии Гиббса, изменение энергии Гельмгольца (W, Q, ∆ Н, ∆ S, Δ U, Δ G, Δ F) (считать газ идеальным):
1) для газа и для всей изолированной системы в целом;
2) при свободном расширении газа (расширение в вакууме необратимо), для газа и для всей изолированной системы в целом.
2.44. При температуре 298 К энтропия ромбической серы 32,04 Дж/(моль·К), а энтропия моноклинной серы 32,68 Дж/(моль·К). Энтальпии сгорания соответственно равны –297948 и –298246 Дж/моль. Рассчитать изменение энергии Гиббса (Δ G) для реакции S (ромб) = S (мон). В первом приближении различием плотностей ромбической и моноклинной серы можно пренебречь. Какой вывод можно сделать из полученного результата?
2.45. При температуре 298 К и давлении 1 атм молярная энтропия алмаза равна 2,457, а графита 5,73 Дж/К. Теплота сгорания алмаза 387,9, а графита 382,0 кДж/моль. Плотности алмаза и графита соответственно равны 3,513 ∙103 и 2,26 ∙103 кг/м3. Рассчитать изменение энтальпии (∆ Н 0) перехода алмаза в графит при стандартных условиях (температуре 298 К и давлении 1 атм). Какая форма – графит или алмаз – является стабильной при этих условиях? Может ли быть получена другая стабильная форма при повышении давления? Если да, то каким должно быть давление?
2.46. Вычислить изменение энтальпии, изменение энтропии, изменение внутренней энергии, изменение энергии Гиббса, изменение энергии Гельмгольца (∆ Н, ∆ S, Δ U, Δ G, Δ F) и конечные значения объема и температуры (V, T) при адиабатическом расширении до давления 101 325 Па 1 ∙10–3 м3 кислорода, взятого при температуре 298 К и давлении 506 500 Па. Молярная теплоемкость кислорода при постоянном давлении 20,63 Дж/(моль·К), молярная энтропия при температуре 298 К и давлении 101325 Па составляет 206 Дж/(моль·К).
2.47. Определить, будет ли взаимодействовать этилен с водой при температуре 298 К и давлении 101 325 Па.
2.48. Определить будет ли взаимодействовать водород с кислородом при температуре 180 К и давлении 101 325 Па.
2.49. Определить будет ли взаимодействовать азот с водородом при температуре 700 К и давлении 101 325 Па.
2.50. Вычислить стандартную энергию Гиббса образования ( ) жидкой и газообразной воды, если известны следующие данные:
) жидкой и газообразной воды, если известны следующие данные:
 = –241,82 кДж/моль – Н2О(г);
= –241,82 кДж/моль – Н2О(г);
 = – 285,83 кДж/моль – Н2О(ж);
= – 285,83 кДж/моль – Н2О(ж);
 = 130,68 Дж/(моль·К) – Н2(г);
= 130,68 Дж/(моль·К) – Н2(г);
 = 205,14 Дж/(моль·К) – О2(г);
= 205,14 Дж/(моль·К) – О2(г);
 = 188,83 Дж/(моль·К) – Н2О(г);
= 188,83 Дж/(моль·К) – Н2О(г);
 = 69,91 Дж/(моль·К) – Н2О(ж).
= 69,91 Дж/(моль·К) – Н2О(ж).
2.51. Рассчитать стандартное изменение энергии Гиббса (Δ G 0298) для химической реакции:
4НCl(г) + O2(г) = 2Cl2(г) + 2H2O(ж).
Необходимые для расчета справочные данные взять в приложении 12.
2.52. Рассчитать стандартное изменение энергии Гиббса ( ) для химической реакции:
) для химической реакции:
4Н2(г) + СO2(г) = CН4(г) + 2H2O(ж).
Необходимые для расчета справочные данные взять в приложении 12.
2.53. Рассчитать стандартную энергию Гиббса образования аммиака (Δ G) при температурах 298 и 400 К, используя справочные данные из приложения 12. Принять, что теплоемкости в указанном интервале температур постоянны.
2.54. Рассчитать стандартные изменение энергии Гиббса (Δ G) и изменение энергии Гельмгольца (Δ F) при температуре 60 °C для химической реакции:
CН3СООН(ж) + 2Н2(г) = C2Н5ОН(ж) + H2O(ж).
Необходимые для расчета справочные данные взять в приложении 12. Может ли эта реакция протекать самопроизвольно при данной температуре и стандартных состояниях реагентов? Теплоемкости веществ считать постоянными.
2.55. Рассчитать стандартные изменение энергии Гиббса (Δ G) и изменение энергии Гельмгольца (Δ F) при температуре 700 °C для химической реакции:
CаСО3(т) = CаО(т) + СO2 (г).
Необходимые для расчета справочные данные взять в приложении 12. Может ли эта реакция протекать самопроизвольно при данной температуре и стандартных состояниях реагентов? Теплоемкости веществ считать постоянными.
2.56. Свинцовую дробь массой 200 г нагрели от 20 до 100 °C и погрузили в 1 кг воды, взятой при температуре 20 °C. Определить:
1) сколько теплоты было сообщено дроби при нагревании;
2) какой стала температура системы после смешения;
3) сколько теплоты сообщил свинец воде;
4) какие изменения произошли с внутренней энергией, энтальпией, энтропией и энергиями Гиббса и Гельмгольца в результате этого процесса?
Систему считать изолированной.
2.57. При низких температурах серная кислота устойчива, а при высоких она диссоциирует по уравнению
H2SO4(г) = H2O(г) + SO3(г).
Объяснить это явление и рассчитать температуру, при которой изменение энергии Гиббса (Δ G = 0).
2.58. При низких температурах (вблизи стандартной температуры) окисление азота кислородом по реакции
N2(г) + O2(г) = 2NO(г)
не происходит, а при высоких температурах эта реакция идет самопроизвольно.
Объяснить это явление и определить температуру, выше которой эта реакция может быть использована в химической технологии.
2.59. Почему синтез аммиака по реакции
N2(г) + 3H2(г) = 2NH3(г)
стремятся вести при более низкой температуре?
2.60. В основу современного производства азотной кислоты положена реакция
4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г).
Выяснить влияние изменения температуры на протекание этого процесса. Ответ подтвердить расчетами.
2.61. Почему повышение температуры препятствует протеканию реакции
2NO(г) + O2(г) = 2NO2(г),
а понижение – способствует? Ответ подтвердить расчетами.
2.62. Большинство цветных металлов в промышленности получают алюмотермическим способом, в основу которого положена реакция
2yAl(т) + 3Me x O y (т) = y Al2O3(т) + 3 x Me(т),
предложенная еще Бекетовым.
Выяснить возможность получения таким способом:
1) Si из SiO2 (кварц)
2) As из As2O3 (арсенолит)
3) Ba из BaO(т).
Указать температуры технологического ведения процесса.
2.63. Предполагают, что при синтезе метанола по реакции
СО(г) + 2Н2(г) = СН3ОН(г),
проводимой при температуре 350–400 °C, наряду с основной протекают (особенно при завышении температуры) побочные реакции:
1) СО(г) + 3Н2(г) = СН4(г) + Н2О(г);
2) 2СО(г) + 2Н2(г) = СН4(г) + СО2(г);
3) СО(г) + Н2(г) = НСОН(г).
Верно ли это предположение? Ответ подтвердить расчетами.
2.64. Вывести зависимость Δ G 0 Т от Т для реакции
Н2(г) + Cl2(г) = 2HCl(г).
Необходимые для расчетов справочные данные взять в приложении 12.
2.65. Для реакции

дано  = 43540 + 29,7 lg T + 15,87∙10–3 T 2.
= 43540 + 29,7 lg T + 15,87∙10–3 T 2.
Вычислить изменение энтропии входе этой реакции при температурах 298 и 700 К. Сопоставить полученное значение со справочными данными.
2.66. Для реакции
2Н2(г) + S2(г) = 2H2S(г)
дано Δ G 0 Т = 168300 + 30,35 lg T – 5,07∙10–3 T 2.
Вычислить изменение энтропии входе этой реакции при температурах 298 и 700 К. Сопоставить полученное значение со справочными данными.
Многовариантные задачи
Задача 2.5. Вычислить изменение энтальпии, изменение энтропии, изменение внутренней энергии, изменение энергии Гиббса, изменение энергии Гельмгольца (∆ Н, ∆ S, Δ U, Δ G, Δ F) при смешении V А м3 газа А и V В м3 газа В при температуре Т = 298 К. Начальное давление газов равно 101325 Па. Конечный объем смеси V к = V А + V В. Принять, что данные вещества подчиняются законам идеальных газов.
| Номер варианта | Газ А | V А∙104, м3 | Газ В | V В∙104, м3 |
| Н2 | N2 | |||
| Н2О | Cl2 | |||
| СН4 | Xe | |||
| СО | Kr | |||
| СО2 | Ne | |||
| О2 | F2 | |||
| Не | Ar | |||
| С2Н6 | Н2 | |||
| N2 | Н2О | |||
| Cl2 | СН4 | |||
| Xe | СО | |||
| Kr | СО2 | |||
| Ne | О2 | |||
| F2 | Не | |||
| Ar | С2Н6 | |||
| Н2 | Kr | |||
| Н2О | Ne | |||
| СН4 | F2 | |||
| СО | Ar | |||
| СО2 | Н2 | |||
| О2 | Н2О | |||
| Не | СН4 | |||
| С2Н6 | Н2 | |||
| N2 | Н2О | |||
| Cl2 | СН4 | |||
| Xe | СО | |||
| Kr | СО2 | |||
| Ne | О2 | |||
| F2 | Не | |||
| Ar | С2Н6 |
Задача 2.6. При переходе вещества, пары которого подчиняются законам идеальных газов, из жидкого состояния в газообразное при температуре Т и давлении 101325 Па расходуется теплота парообразования. Принять, что теплота испарения не зависит от температуры. Вычислить изменение энтальпии, изменение энтропии, изменение внутренней энергии, изменение энергии Гиббса, изменение энергии Гельмгольца и работу расширения (∆ Н, ∆ S, Δ U, Δ G, Δ F, W) 1 моль вещества в этом процессе. Определить изменение перечисленных функций, если пары 1 моль вещества нагреваются от температуры Т до Т + 25°: а) изохорически; б) изобарически. На сколько градусов поднялась бы температура вещества, если бы изменение внутренней энергии при переходе из жидкого состояния в газообразное выражалось в повышении температуры?
| Номер варианта | Вещество | Т, К | Номер варианта | Вещество | Т, К | |
| Н2 | 20,4 | N2O | ||||
| Н2О | O2 | |||||
| HCN | Ne | |||||
| H2S | He | |||||
| HCl | SO2 | |||||
| HBr | Cl2 | |||||
| HI | F2 | |||||
| CO | Br2 | |||||
| CO2 | Kr | |||||
| CS2 | Xe | |||||
| C2N2 | Ar | |||||
| CNCl | Rn | |||||
| N2 | NO2 | |||||
| NH3 | 239,7 | CCl4 | ||||
| NO | Hg |
Задача 2.7. Выполнить следующие задания для приведенной реакции:
1. Что называется тепловым эффектом химической реакции? Через какие термодинамические функции состояния можно выразить тепловой эффект? По значениям стандартных энтальпий образования участвующих в реакции веществ ( ), вычислить тепловой эффект реакции при стандартных условиях (
), вычислить тепловой эффект реакции при стандартных условиях ( ). Выделяется или поглощается тепло при протекании реакции? Эндо- или экзотермической является данная реакция?
). Выделяется или поглощается тепло при протекании реакции? Эндо- или экзотермической является данная реакция?
2. Что называется молярной изобарной теплоемкостью вещества ( )? Какова зависимость молярной изобарной теплоемкости от температуры? Вывести функциональную зависимость изменения молярной изобарной теплоемкости для реакции от температуры:
)? Какова зависимость молярной изобарной теплоемкости от температуры? Вывести функциональную зависимость изменения молярной изобарной теплоемкости для реакции от температуры:  = f (T).
= f (T).
3. Пользуясь законом Кирхгофа и установленной функциональной зависимостью  = f (T), вычислить тепловой эффект реакции при температуре T и стандартном давлении (
= f (T), вычислить тепловой эффект реакции при температуре T и стандартном давлении ( ). Как влияет увеличение температуры на величину теплового эффекта реакции?
). Как влияет увеличение температуры на величину теплового эффекта реакции?
4. Что характеризует энтропия системы? Качественно оценить знак изменения энтропии (D S) при протекании реакции. Объяснить полученный результат.
5. По значениям стандартных энтропий участвующих в реакции веществ ( ) вычислить изменение энтропии реакции при стандартных условиях (
) вычислить изменение энтропии реакции при стандартных условиях ( ).
).
6. Используя функциональную зависимость  = f (T), вычислить изменение энтропии реакции при температуре T и стандартном давлении (
= f (T), вычислить изменение энтропии реакции при температуре T и стандартном давлении ( ). Как влияет повышение температуры на величину D S 0?
). Как влияет повышение температуры на величину D S 0?
7. Что характеризует энергия Гиббса (G) и изменение энергии Гиббса (D G)? Качественнооценить вероятность самопроизвольного протекания реакции при высоких и низких температурах. Вычислить изменение энергии Гиббса реакции, протекающей при стандартных условиях (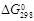 ). Возможно ли самопроизвольное протекание процесса при стандартных условиях? Определить температуру (T 0) (если такая имеется), выше которой реакция меняет свое направление.
). Возможно ли самопроизвольное протекание процесса при стандартных условиях? Определить температуру (T 0) (если такая имеется), выше которой реакция меняет свое направление.
8. Вычислить изменение энергии Гиббса реакции, протекающей при стандартном давлении и температуре T ( ), считая, что D H 0 T и
), считая, что D H 0 T и  не зависят от температуры (метод Улиха). Построить график зависимости
не зависят от температуры (метод Улиха). Построить график зависимости  от температуры. Сделать вывод о влиянии температуры на вероятность самопроизвольного протекания процесса в прямом направлении.
от температуры. Сделать вывод о влиянии температуры на вероятность самопроизвольного протекания процесса в прямом направлении.
9. Вычислить изменение энергии Гиббса реакции ( ) при температуре T и стандартном давлении, учитывая зависимость D H 0 T и
) при температуре T и стандартном давлении, учитывая зависимость D H 0 T и  от температуры. Сравнить полученные значения
от температуры. Сравнить полученные значения  с величиной изменения энергии Гиббса, рассчитанной по методу Улиха, и оценить их расхождение.
с величиной изменения энергии Гиббса, рассчитанной по методу Улиха, и оценить их расхождение.
| Номер варианта | Реакция | Т, К |
| 4NH3(г) + 5O2(г) = 4NO(г) + 6H2O(г) | ||
| 4HCl(г) + O2(г) = 2Cl2(г) + 2H2O(г) | ||
| 2AgNO3(т) = 2Ag(т) + 2NO2(г) + O2(г) | ||
| 2NaHCO3(т) = Na2CO3(т) + H2O(г) + CO2(г) | ||
| 2CuS(т) + 3O2(г) = 2CuO(т) + 2SO2(г) | ||
| Fe3O4(т) + 4H2(г) = 3Fe(т) + 4H2O(г) | ||
| 2H2S(г) + 3O2(г) = 2SO2(г) + 2H2O(г) | ||
| 4Fe(OH)2(т) + O2(г) + 2H2O(г) = 4Fe(OH)3(т) | ||
| CS2(г) + 3O2(г) = CO2(г) + 2SO2(г) | ||
| MgCO3(т) = MgO(т) + CO2(г) | ||
| Fe2O3(т) + 3H2(г) = 2Fe(т) + 3H2O(г) | ||
| 2KСlO3(т) = 2KCl(т) + 3O2(г) | ||
| BaO(т) + CO2(г) = BaCO3(т) | ||
| 4HBr(г) + O2(г) = 2Br2(г) + 2H2O(г) | ||
| 4NH3(г) + 3O2(г) = 2N2(г) + 6H2O(г) | ||
| CaCO3(т) = CaO(т) + CO2(г) | ||
| 4FeS2(т) + 11O2(г) = 2Fe2O3(т) + 8SO2(г) | ||
| 2H2S(г) + O2(г) = 2H2O(г) + 2S(т) | ||
| FeO(т) + H2(г) = Fe(т) + H2O(г) | ||
| CaO(т) + H2O(г) = Ca(OH)2(т) | ||
| Al2O3(т) + 3SO3(г) = Al2(SO4)3(т) | ||
| 2NO(г) + O2(г) = 2NO2(г) | ||
| 2Pb(NO3)2(т) = 2PbO(т) + 4NO2(г) + O2(г) | ||
| CuSO4∙5H2O(т) = CuSO4(т) + 5H2O(г) | ||
| PbO(т) + SO3(г) = PbSO4(т) | ||
| 4CO(г) + 2SO2(г) = 4CO2(г) + S2(г) | ||
| CO(г) + H2O(г) = CO2(г) + H2(г) | ||
| 2HF(г) + O3(г) = H2O(г) + F2(г) +O2(г) | ||
| O3(г) + H2O2(ж) = 2O2(г) + H2O(ж) | ||
| N2O(г) + NO2(г) = 3NO(г) |

Не нашли, что искали? Воспользуйтесь поиском: