
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Лабораторна робота №1. Гідроґен та його сполуки
Мета: закріпити знання про фізико-хімічні властивості Гідроґену та його сполук, розвивати навички виконання лабораторного хімічного експерименту.
Реактиви: Zn(гранули), H2SO4-2M, Al(гранули), KOH-2M, Ca (метал), Cu, H2O2 — 10%, KI – 0,2М, KMnO4 – 0,1М.
Обладнання: пробірки, газовідвідні трубки для пробірок,спиртівки, сірники, тримачі для пробірок, мікроапарат Кіппа, штативи.
| № | Хід виконання досліду | Рівняння реакції | Спостереження | Висновки | |
| 1. Отримання водню | |||||
| 1а | Отримання водню взаємодією металу з кислотою. У пробірку покладіть декілька гранул цинку, додайте 2мл розчину 4н сульфатної кислоти з 4н закрийте отвір пробірки пробкою з газовідвідною трубкою. Перевірте водень на чистоту. Для цього на кінець трубки надіньте пробірку, яку через кожні 2хв знімайте і, не перевертаючи, підносьте до полум’я. Чистий водень горить спокійно, змішаний із киснем дає слабкий вибух. Якщо водень, що виділяється, чистий, то підпаліть його запаленою скіпкою біля отвору газовідвідної трубки. Над полум’ям водню потримайте холодну скляну лійку. | Напишіть рівняння реакцій.
 Рис1. Прилад для одержання водню
Рис1. Прилад для одержання водню
| Спостерігати виділення газу, горіння суміші водню з киснем та чистого водню. | Як можна отримати водень в лабораторії? Як перевірити чистоту водню? Який продукт утворюється при горінні водню? | |
| 1б | Отримання водню взаємодією металу з лугом. Покладіть у пробірку декілька шматочків алюмінію і долийте 2мл розчину 2М KOH, підігрійте. Закрийте отвір пробірки пробкою з газовідвідною трубкою, на кінець трубки надіньте пробірку. Через 2хв зніміть пробірку і не перевертаючи підпаліть газ. | Напишіть рівняння реакції. | Спостерігати виділення газу, та його горіння | Який газ виділяється? При взаємодії яких металів з лугами можна отримати водень? | |
| 1в | Отримання водню взаємодією металу з водою. Заповніть пробірку до самого краю водою. Закрийте отвір пальцем, занурте в кристалізатор із водою отвором вниз і в такому стані закріпіть у лапці штатива. Шматочок металічного кальцію за допомогою пінцета внесіть у пробірку, опустіть пробірку до дна кристалізатора. З’ясуйте, який газ виділяється. | Напишіть рівняння реакції.
 Рис2. Прилад для одержання водню
Рис2. Прилад для одержання водню
| Який газ виділяється? При взаємодії яких металів з водою можна отримати водень? | ||
| 2. Відновні властивості водню | |||||
| 2а | Взаємодія CuO із Н2. Складіть прилад, як показано на малюнку. Добудьте водень взажмодією Zn із H2SO4. Перевірте водень на чистоту. Якщо водень чистий, вставте газовідвідну трубку в пробірку з порошком купрум(ІІ) оксиду якомога ближче до його поверхні. Запаліть сухе пальне та нагрівайте пробірку з оксидом. Спостерігайте за перебігом реакцій. |  Рис2. Прилад для відновлення CuO воднем
Складіть рівняння реакцій, зрівняйте методом електронного балансу. Рис2. Прилад для відновлення CuO воднем
Складіть рівняння реакцій, зрівняйте методом електронного балансу.
| Зміну забарвлення CuO та виділення води. | Які властивості проявляє Н2? | |
| 3а | Взаємодія KI з Н2О2. У пробірку з розчином калій йодиду додайте рівний об’єм розведеної сульфатної кислоти, потім долийте 1-2 мл гідроген пероксиду. | Складіть рівняння реакції, зрівняйте методом іонно-електронного балансу. | Відмітьте зміну забарвлення розчину. | Які властивості проявляє Н2O2? | |
| 3б | Взаємодія калій перманганату з ґідрогенпероксидом у кислому середовищі В пробірку налийте 0,5мл розчину калію перманганату і додайте 1-2мл сульфатної кислоти, а потім 1мл 10%-ного розчину Н2О2. Підігрійте. | Складіть рівняння реакції, зрівняйте методом іонно-електронного балансу. | Відмітьте зміну забарвлення розчину та виділення газу. | Які властивості проявляє Н2O2? | |
Завдання для самостійної роботи
1. Як добувають водень в лабораторії та у промисловості?
2. Які окисно-відновні властивості проявляє водень? Відповідь підтвердіть рівняннями реакцій.
3. Наведіть приклади застосування Ґідроґену та його сполук.
4. Ґідрогенпероксид, одержання і окисно-відновні властивості.
5. Яка маса гідроген пероксиду необхідна для добування 1,12 дм 3 (н.у.) кисню.
6. Під час реакції 1 г водного розчину гідроген пероксиду з надлишком калій дихромату в присутності сульфатної кислоти виділилося 200 см3 газу (при температурі 27˚С та тиску 100 кПа). Визначте масову частку гідроген пероксиду в розчині.
7. Допишіть рівняння реакцій.
а) Zn _ NaOH ®
б) 
в) 
8. Вкажіть графічну формулу H2O2, що відображає молекулу з мінімальною внутрішньою енергією:

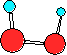

 .
.
А) Б) В) Г)
9. Допишіть рівняння реакцій. Урівняйте методом іонно-електронного балансу.
а) H2S + H2O2 →;
б) Cr2(SO4)3 + H2SO4+ H2O2 →;
в) CrCl3 + KOH+ H2O2 ® K2CrO4 +…
в) HI+ H2O2 ®
10. Яка концентрація H2O2 (% мас.) була в розчині якщо із 100мл цього розчину повністю прореагував 0,01моль KMnO4.
11. Визначіть об’єм водню (н.у.) що виробляє електролізер за годину роботи, якщо сила струму на електродах 20кА.
Література
1. Бабич Л.В., Балезин С.А., Гликина Ф.Б. и др. Практикум по неорганической химии. - М.: Просвещение, 1991 г. - 320 с.
2. Романова Н.В. Загальна і неорганічна хімія. – К.: Вища школа, 1988 г. – 432 с
3. Ахметов Н.О. Общая и неорганическая химия. М.:Высшая школа, 2001. - 743c.
4. Ахметов Н.С., Азизова М.К., Бадыгина Л.И. Лабораторные и семинарские занятия по неорганической химии.-М.:Высшая школа,1988.-303 с
5. Глинка Н.Л. Общая химия. Л.:Химия, 1983. - 730с
6. Некрасов Б.В. Основы общей химии. М.Химия, 1973. -1т. - 656.с
7. Некрасов Б.В. Основы общей химии. М.:Химия, 1973. -2т. - 688с.
8. Химическая энциклопедия под. ред. Кнунянц И.Л. М: Советская энциклопедия, 1988.
9. Боднарчук О.В., Стецьків А.О. Практикум з неорганічної хімії. Івано-Франківськ –2008. – 36.с.
10. Євсєєва М. В., Гордієнко О.А., Звуздецька Н. С. Хімія неметалів. Лабораторний практикум. Вінниця ВДТУ, 2003.
| <== предыдущая лекция | | | следующая лекция ==> |
| Соотношение частной и общественной собственности | | |
Не нашли, что искали? Воспользуйтесь поиском: