
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Строение карбоксильной группы
Элементы, входящие в карбоксильную группу имеют неодинаковую величину электроотрицательности: С(sp2) – 2,69; O – 3,5 и H – 2,2. Электронная плотность смещена в сторону кислорода, что приводит к поляризации связей. Карбоксильная группа представляет собой плоскую сопряженную систему, в которой возникает р,p-сопряжение при взаимодействии р-орбитали атома кислорода гидроксогруппы с p-связью. Наличие р,p-сопряжения в карбоксильной группе карбоновых кислот способствует равномерному распределению отрицательного заряда в карбоксилат-ионе, образующемся при отщеплении протона.

Наличие р,p-сопряжения в карбоксильной группе карбоновых кислот значительно повышает кислотные свойства карбоновых кислот по сравнению со спиртами. Кислород ОН-группы испытывает некоторый дефицит электронов, поэтому он вызывает смещение электронной плотности от атома водорода на себя. Атом водорода становится подвижным и может уходить в виде протона. Подвижность протона способствует образованию солей карбоновых кислот (механизм реакции SE).
Для карбоновых кислот наиболее характерны реакции нуклеофильного замещения ОН-группы в карбоксиле (механизм SN). В реакциях, при которых происходит замещение атома (или группы атомов) на нуклеофил, имеет место нуклеофильное замещение SN. Нуклеофилы являются донорами электронов: OH-, RO-, CN-, -NH2, R-O-R, R-OH и т.д. В реакциях SN от молекулы отщепляется атом (или группы атомов) с отрицательным зарядом и заменяется нуклеофилом:

Чем стабильнее уходящий ион (:Х), тем легче идут реакции нуклеофильного замещения. Реакции SN у карбоновых кислот протекают в присутствии кислотного катализатора. Реакции нуклефильного замещения гидроксила у sp2-гибридизованного атома углерода приводят к образованию функциональных производных карбоновых кислот:
1. Реакция этерификации. Замещение гидроксила в карбоксиле остатком спирта приводит к образованию сложных эфиров. Реакция этерификации идет при нагревании кислот со спиртами в присутствии водоотнимающих веществ:

СН3СООН + С2Н5ОН ↔ СН3СО-ОС2Н5 + Н2О
этилацетат
Реакция обратима и протекает до установления равновесия. Сдвиг равновесия вправо осуществляется за счет удаления из реакционной смеси одного из конечных продуктов.
Гидролиз сложных эфиров (в отличие от реакции этерификации) может быть осуществлен как в кислой, так и в щелочной среде.
2.Галогенангидриды кислот - это производные, в которых гидроксильная группа карбоксила замещена на галоген. Галогенангидриды образуются при действии на кислоту галогенидов фосфора (PCl5, PCl3) или тионилхлорида (SOCl2):

Галогенангидриды – это высокоактивные нуклеофилы, применяются в различных синтезах как активные ацилирующие агенты для введения в молекулу вещества остатка кислоты.
3.Образование ангидридов кислот – замещение гидроксила в карбоксиле на остаток кислоты.

Ангидриды монокарбоновых кислот чаще всего получают взаимодействием хлорангидридов кислот и натриевых солей этих кислот.
4.Образование амидов кислот - замещение гидроксила в карбоксиле на остаток аммиака – аминогруппу – NH2

Лучше протекает реакция, если действовать аммиаком на галогенангидриды кислот.
5. В организме человека довольно часто встречаются реакции образования тиоэфиров. Так, в тканях содержится тиол НS–KoA (кофермент А - кофермент ацилирования), который может реагировать с карбоновыми кислотами по уравнению:
СН3СООН + НS-KoA → Н2О + СН3СО-S-КоА
Реакции такого рода катализируются сложными ферментными системами и заканчиваются образованием тиоэфиров, в такой форме карбоновые кислоты используются в реакциях обмена веществ.
Декарбоксилирование – одна из наиболее важных реакции карбоновых кислот. Незамещенные монокарбоновые кислоты декарбоксилируются трудно.
Двухосновные карбоновые кислоты при нагревании легко декарбоксилируется:
НООС-СООН → НСООН + СО2
НООС–СН2–СООН → СН3СООН + СО2
Большое значение имеет ферментативное декарбоксилирование α- и β-оксокислот, а так же α-аминокислот в организме.
В водных растворах карбоновые кислоты диссоциируют:
СН3СООН ↔ СН3СОО- + Н+
Все карбоновые кислоты – слабые электролиты (НСООН – средней силы). Карбоновые кислоты в реакциях электрофильного замещения образуют соли:
СН3СООН + NaOH → СН3СООNa + Н2О
Соли щавелевой кислоты (оксалаты) трудно растворимы и часто образуют камни в почках и мочевом пузыре (оксалатные камни). К таким солям относится оксалат кальция.
4. Иллюстративный материал: презентация
5. Литература:
Основная литература:
1. Биоорганическая химия: учебник. Тюкавкина Н.А., Бауков Ю.И. 2014г.
2. Сейтембетов Т.С. Химия: учебник - Алматы: ТОО"ЭВЕРО", 2010. - 284 с
3. Болысбекова С. М. Химия биогенных элементов: учебное пособие - Семей, 2012. - 219 с.: ил
4. Веренцова Л.Г. Неорганическая,физическая и коллоидная химия: учебное пособие - Алматы: Эверо, 2009. - 214 с.: ил.
5. Физическая и коллоидная химия /Под ред.А.П.Беляева.- М.: ГЭОТАР МЕДиа, 2008
6. Веренцева Л.Г. Неорганическая, физическая и коллоидная химия,(проверочные тесты) 2009
Дополнительная литература:
- Равич-Щербо М.И., Новиков В.В. Физическая и коллоидная химия. М. 2003.
2. Слесарев В.И. Химия. Основы химии живого. С-Пб.: Химиздат, 2001
3. Ершов Ю.А. Общая химия. Биофизическая химия. Химия биогенных элементов. М.: ВШ, 2003.
4. Асанбаева Р.Д., Илиясова М.И. Теоретические основы строения и реакционной способности биологически важных органических соединений. Алматы, 2003.
- Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М., Дрофа,2003.
- Глинка Н.Л. Общая химия. М.,2003.
- Пономарев В.Д. Аналитическая химия ч.1,2 2003
6. Контрольные вопросы (обратная связь):
Тест «Пятерочка»
(На некоторые вопросы возможно более одного варианта ответа.)
1. Какие из названных кислот являются органическими?
• а) Муравьиная; б) азотная;
• в) серная; г) лимонная.
2. Почему болезненны укусы муравьев?
• а) Обжигают муравьиной кислотой;
• б) выделяют яд;
• в) разъедают муравьиной щелочью;
• г) вонзают острые зубчики.
3. Как называют соли карбоновых кислот?
• а) ацетаты; б) бустилаты;
• в) пропилаты; г) постулаты.
4. Какого названия кислоты не существует?
• а) Лимонная; б) щавелевая;
• в) винная; г) виноградная.
5. Какие кислоты являются витаминами?
• а) Никотиновая; б) аскорбиновая;
• в) ацетилсалициловая; г) янтарная.
Лекция №5
1. Тема: Углеводы.
2. Цель: Сформировать знания о классификации, о строении, о химических свойствах углеводов. Изучение темы способствует, формирует знание о строении и свойствах углеводов, как основу для понимания их метаболизма в живом организме
3. Тезисы лекции:
3.1. План лекции
1. Углеводы, классификация, карбонильные и проекционные формулы Фишера, формулы Колли-Толленса, формулы Хеуорса.
2. Моносахариды - строение, изомерия, таутомерия.
3. Химические свойства моносахаридов
4. Дисахариды: мальтоза, целлобиоза, лактоза, сахароза.
5. Полисахариды: гомополисахариды и гетерополисахариды.
6. Биологическое значение углеводов.
3.2. Тезисы лекции
Углеводы – широко распространенные в живой природе органические соединения. Термин «углеводы», предложен в 1844 г химиком К. Шмидтом (Россия) в связи с тем, что большинство представителей этого класса по составу отвечало сочетанию углерода с водой, например: С6Н12О6 → 6С + 6Н2О; Сn(H2O)n.
Класс углеводов делят на две группы:
- простые углеводы (моносахариды) или монозы
- сложные углеводы (гомополисахара и гетерополисахара)
Простые углеводы не способны гидролизоваться, а сложные углеводы гидролизуются с образованием простых углеводов.
Моносахариды - это гетерофункциональные соединения. Они представляют собой альдегиды и кетоны многоатомных спиртов (или их циклические полуацетали). В зависимости от наличия альдегидной или кетонной группы различают альдозы и кетозы. Моносахариды содержат в молекуле от 3 до 10 углеродных атомов.
Изомерия моносахаридов связана с наличием: 1) альдегидной и кетонной групп; 2) асимметрических углеродных атомов (оптическая изомерия). Принадлежность моносахаридов к D- или L- ряду определяется правилом М.А. Розанова: по конфигурации самого удаленного от старшей (карбонильной) группы асимметричного атома углерода (пентозы С-4, гексозы С-5).
Карбонильные формулы гексоз:




D-глюкоза D-манноза D-галактоза D-фруктоза
Моносахариды существуют в виде ациклических (карбонильные формы) и циклических полуацетальных форм. Ациклические и циклические формы моносахаридов являются изомерами по отношению друг к другу. Такой вид изомерии называется цикло-оксо-таутомерией.
Циклические (Хеуорса) формулы гексоз:



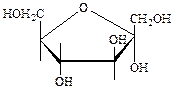
a-D-глюкоза b-D-глюкоза a-D-галактоза b-D-фруктоза
Для сахаров в циклическом виде возможна конформационная изомерия, связанная с расположением в пространстве углеродных атомов шестичленного цикла. Реакции полуацетального гидроксила. Моносахариды имеющие строение циклических полуацеталей, при взаимодействии со спиртами в присутствии кислотного катализатора в безводных условиях, образуют полные ацетали.
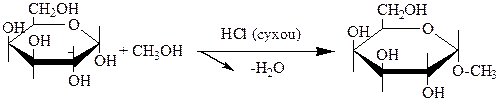
a-D-галактопираноза Метил-a-D-галактопиранозид
Полуацетальный или гликозидный гидроксил не проявляет свойств спиртов, а ведет себя специфически, образуя О- и N-гликозиды. Гликозиды, как и все ацетали, гидролизуются в кислой среде, устойчивы к действию разбавленных щелочей. Гидролиз гликозидов представляет собой реакцию обратную реакции образования гликозидов
Как многоатомные спирты моносахариды растворяют гидроксид меди (II), образуя хелатное соединение синего цвета. Эта реакция используется для обнаружения моносахаридов и гликозидов.
Простые эфиры образуются при взаимодействии с галогеналканами. Одновременно со спиртовыми гидроксильными группами в реакцию вступает и полуацетальный гидроксил, в результате чего получается простой эфир гликозида.



Простой эфир Сложные эфиры: фосфаты α-глюкозы и α-фруктозы
Сложные эфиры образуются по реакции этерификации ОН-групп под действием кислородсодержащих кислот (органических и неорганических) или их ангидридов. Биологическое значение имеют эфиры фосфорной кислоты – фосфаты.
Восстановление карбонильной группы моносахаридов водородом на никеле или палладии приводит к образованию многоатомных спиртов: глюкоза – сорбит (D-глюцит), манноза - маннит, D-ксилоза - ксилит, галактоза - дульцит. Ксилит и сорбит – сладкие на вкус кристаллические вещества, хорошо растворимые в воде, используются как заменители сахара при сахарном диабете. Сорбит является промежуточным продуктом в промышленном получении аскорбиновой кислоты (витамин С).
Не нашли, что искали? Воспользуйтесь поиском: