
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Теоретическая часть.
Лабораторная работа «Определение молярной массы эквивалентов вещества в реакциях обмена».
Цель работы: Определение молярной массы эквивалентов кислоты методом кондуктометрического титрования щелочью.
Идентификация кислоты. Расчет ошибку (погрешности) определения молярной массы эквивалентов кислоты.
Теоретическая часть.
Химическим эквивалентом (Э(В)) (по рекомендациям ИЮПАК) называется условная или реальная частица, равная или в целое число раз меньшая соответствующей ей формульной единице:
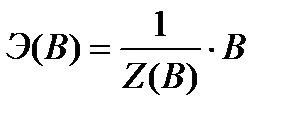
где «В» – формульная единица вещества: реально существующая частица, такая как атом (Cu, Na, C), молекула (N2, KOH, Al2(SO4)3, CO2), ионы (OH-, SO42-, Cu2+), радикалы (-NО2, С2Н5-), условные молекулы кристаллических веществ и полимеров, любые другие частицы вещества.
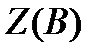 - эквивалентное число, показывающее какое число эквивалентов вещества «В» условно содержится в данной формульной единице этого вещества.
- эквивалентное число, показывающее какое число эквивалентов вещества «В» условно содержится в данной формульной единице этого вещества.
 = fэкв. - фактор эквивалентности.
= fэкв. - фактор эквивалентности.
Эквивалентное число Z всегда больше или равно 1 и является безразмерной величиной.
Расчет эквивалентного числа различных формульных единиц представлен в таблице 1.1.
Таблица 1.1. Расчет эквивалентного числа Z вещества.
| частица | эквивалентное число Z | Пример |
| Элемент | Z (Э) = В(Э), где В(Э) – валентность элемента | Z (S)H2SO4 = 6 Z (C)CO2 = 4 |
| Простое вещество | Z (в-ва) = n(Э)∙В(Э), где n(Э) – число атомов элемента В(Э) – валентность элемента | Z (O2) = 2∙2=4 Z (Cl2) = 2∙1=2 |
| Оксид | Z (Э2Ох) = n(Э)∙В(Э), где n(Э) – число атомов элемента В(Э) – валентность элемента | Z (Н2О) = 2∙1=2 Z (SО2) = 1∙4=4 Z (Al2О3) = 2∙3=6 |
| Кислота | Z (к-ты) = n(Н+), где n(Н+) – число отданных в ходе реакции ионов Н+ (основность кислоты) | Z (Н2SО4) = 1 – основность равна 1 Z (Н2SО4) = 2 – основность равна 2 |
| Основание | Z (осн-я) = n(ОН-), где n(ОН-) – число отданных в ходе реакции гидроксид ионов ОН- (кислотность основания) | Z (Са(ОН)2 = 1 – кислотность равна 1 Z (Са(ОН)2) =2 – кислотность равна 2 |
| Соль | Z (соли) = n(Ме)∙В(Ме) = n(А)∙В(А), где n(Ме), В(Ме) – число атомов металла и его валентность n(А), В(А) – число кислотных остатков и их валентность | Z (Na2SО4) = 2∙1=1∙2=2 Z (Al2(CO3)3) = 2∙3=3∙2=6 |
| Частица в ОВР | Z (частицы) = nе, где n е – число электронов, участвующих в процессе, на одну формульную единицу | SO42-+2H++ +2e→SO32-+H2O Z (SО42-)=2, Z (H+)=1 2Cl- - 2e→Cl2 Z (Cl-)=1, Z (Cl2)=2 |
| ион | Z (иона) = n, где n – заряд иона | Z (SО42-) = 2 |
Величины эквивалентного числа, а, следовательно, и эквивалента зависят от химической реакции, в которой участвует данное вещество.
Например, в реакции нейтрализации фосфорной кислоты, эквивалентное число (эквивалент) кислоты меняется в зависимости от полноты протекания реакции.
Для реакции H3PO4 + 3KOH → K3PO4 + 3H2O эквивалентное число Z (H3PO4) = n (Н+) = 3, т.к. в реакции участвуют три иона Н+ фосфорной кислоты, и эквивалентом H3PO4 будет являться условная частица 1/3H3PO4 (Э(H3PO4) = 1/3H3PO4).
В реакции H3PO4 + KOH → KН2PO4 + H2O замещается только один ион водорода Н+ и поэтому Z (H3PO4) = n (Н+) = 1, а эквивалентом кислоты является частица H3PO4 (Э(H3PO4)= 1H3PO4).
В обменных реакциях эквивалентное число (эквивалент) определяется стехиометрией реакции. Находят наименьшее общее кратное всех стехиометрических коэффициентов в уравнении реакции и делят стехиометрические коэффициенты на найденное наименьшее общее кратное.
Например, в реакции Cr2(SO4)3 + 6KOH → 2Cr(OH)3 + 3K2SO4
наименьшее общее кратное всех стехиометрических коэффициентов равно 6:
1/6Cr2(SO4)3 + KOH → 1/3Cr(OH)6 + 1/2K2SO4
Следовательно, эквивалентное число Z (Cr2(SO4)3) = 6, Z (КОН) = 1, Z (Cr(OH)3) = 3, а Z (K2SO4) = 2. Эквивалентом Cr2(SO4)3 будет являться условная частица 1/6Cr2(SO4)3, Э(КОН)=1КОН, Э(Cr(OH)3) = 1/3Cr(OH)3, Э (K2SO4) = 1/2K2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой Мэ(В), молярным объемом Vэ(В) и определенным количеством вещества n э(В).
Количество вещества эквивалента (nэ) – величина, пропорциональная отношению числа эквивалентов вещества (N э) к числу Авогадро (N А), равному 6,02∙1023 формульных единиц (ф.е.):
n э = N э/ N А, [моль]
(по аналогии с количеством вещества: n = N / N А, [моль])
Так как в одной формульной единице (атоме, молекуле, радикале и т.д.) содержится Z (В) эквивалентов вещества, то число химических эквивалентов вещества N э равно произведению Z (В) на N ф.е.,
N э = Z (В) ∙ N ф.е
и, соответственно,
n э = Z (В) ∙ n, [моль]
Таким образом, моль эквивалентов вещества – это количество вещества, содержащее 6,02∙1023 эквивалентов.
Молярной массой эквивалентов вещества (Мэ(В)) называется масса одного моль эквивалентов вещества В, равная отношению массы вещества (m (В)) к количеству вещества эквивалентов (n э(В)):
Мэ(В) = m (В)/ n э(В); [г/моль] или [кг/моль]
Взаимосвязьмеждумолярной массой вещества М(В) и молярной массой его эквивалентов Мэ(В) выражается соотношением:
Мэ(В) = М(В) / Z (В),
т.е. молярная масса эквивалентов вещества всегда в Z раз меньше молярной массы этого вещества.
Молярную массу эквивалентов сложного вещества можно представить, как сумму молярных масс эквивалентов образующих его составных частей. Например,
Мэ(оксида) = Мэ(элемента) + Мэ(кислорода);
Мэ(кислоты) = Мэ(Н+) + Мэ(кислотного остатка);
Например, молярная масса эквивалентов основной соли сульфата кальция равна: Мэ((CaOH)2SO4) = Мэ((CaOH)+) + Мэ(SO42-)=
= 
Молярным объемом эквивалентов газообразного веществаV э(В) называетсяобъем одного моль эквивалентов газообразного вещества, равный отношениюобъема данного газообразного вещества (V газ) к количеству вещества эквивалентов газообразного вещества:
V э (газа) = V газ / n э, [л/моль]
Учитывая, что для газов, принимаемых условно за идеальные, n = V / V М,
где V М = 22,414л/моль – объем одного моль любого газа при нормальных условиях (н.у.: Т=273,15К, р=1,01325∙105 Па или 1 атм, или 760 мм рт.ст.), тогда молярный объем эквивалентов любого газа равен:
V э (газа) = V М/ Z (В) = 22,414 / Z (В), л/моль.
Не нашли, что искали? Воспользуйтесь поиском: