
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Закон эквивалентов(И.Рихтер 1792г.): количества вещества эквивалентов всех участвующих в реакции веществ равны .
Например, для реакции аА + вВ → сС + dD будут справедливы равенства:
n э(А) = n э(В) = n э(С) = n э(D)
или

Если вещества газообразные, то закон эквивалентов принимает вид:

Закон эквивалентов для реагирующих веществ, находящихся в растворе выражается, как равенство:
сэ(А)∙Vр-ра(А) = сэ(В)∙Vр-ра(В),
где сэ(i) =  моль/л - молярная концентрация эквивалента i вещества, равная отношению количества вещества эквивалента nэ(i) к объему раствора вещества Vp-pa(i).
моль/л - молярная концентрация эквивалента i вещества, равная отношению количества вещества эквивалента nэ(i) к объему раствора вещества Vp-pa(i).
Одним из методов определения концентрации раствора является метод кондуктометрического титрования. Кондуктометрическое титрование – метод определения точки эквивалентности по изменению величины электропроводности раствора. Суть метода заключается в том, что в точный объем анализируемого раствора добавляют титрант и определяют изменение электропроводности раствора. Электропроводность – способность вещества проводить электрический ток. Количественной мерой этой способности является удельная электропроводность κ (каппа):
κ =1/RS [1/(Ом∙м) = См/м (сименс/м)],
где R – электрическое сопротивление проводника (Ом), длина которого l (м) и площадь поперечного сечения S (м2). В химии чаще используют мСм·см-1 (миллисименс/см).
В данной работе используется титрование сильной кислоты сильным основанием. В начале титрования электропроводность раствора высокая, т.к. сильная кислота практически полностью диссоциирована на ионы. Известно, что самой большой подвижностью обладают ионы Н+ и ОН-. В процессе титрования сильной кислоты щелочью происходит замещение ионов водорода менее подвижными ионами натрия, при этом количество ионов Н+ падает за счет связывания с ионами гидроксила в мало диссоциированную воду Н+ + ОН- = Н2О. Следовательно, в процессе нейтрализации электропроводность раствора постепенно убывает, пока все ионы Н+ не будут замещены ионами Na+, т.е. пока кислота не будет полностью нейтрализована. В этот момент электропроводность достигает минимального значения и данная точка называется точкой эквивалентности. При дальнейшем добавлении щелочи ионы ОН- перестают связываться, общее число ионов увеличивается и электропроводность начинает расти. Подъем линии электропроводности после точки эквивалентности менее крутой, т.к. подвижность ионов ОН- меньше, чем ионов Н+ (см.рис.1).
| Объем титранта, мл |

Рис.1. Изменение электропроводности раствора при кондуктометрическом титровании сильной кислоты сильным основанием.
В точке эквивалентности выполняется закон эквивалентов
n э(к) = n э(щ)или с э(к)∙ V р-ра(к) = с э(щ)∙ V р-ра(щ). (1)
Зная объем раствора исследуемой кислоты V (к), объем раствора щелочи, пошедший на титрование V (щ) и ее исходную концентрацию, можно вычислить молярную концентрацию эквивалентов кислоты с э(к):
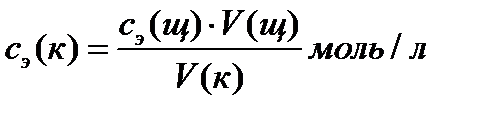 . (2)
. (2)
Если к тому же известна масса растворенной кислоты (например, титр), можно найти молярную массу эквивалента кислоты.
Титр (Т) – один из способов выражения концентрации раствора, показывающий массу (г) растворенного вещества в 1 мл раствора:
Т = m/V, г/мл.
Молярная масса эквивалентов кислотыможет быть вычислена из соотношений:



 (3)
(3)
Не нашли, что искали? Воспользуйтесь поиском: