
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Тема 1.3. Строение вещества
Химическая связь – взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Химическая связь может быть внутримолекулярной и межмолекулярной.
 |
Большое значение для формирования химической связи имеют:
1) длина связи - расстояние между взаимодействующими атомами,
2) энергия ионизации - энергия, которую необходимо затратить для отрыва электрона от атома,
3) электроотрицательность (ЭО)– способность атомов притягивать к себе электроны от других атомов. В периоде ЭО возрастает слева направо, а в группе ЭО понижается сверху вниз. Самой большой электроотрицательностью обладает фтор.
Ковалентная химическая связь (1916 г., Льюис) – связь, образующаяся между атомами за счет образования общих электронных пар, это двухэлектронная связь, принадлежащая одновременно ядрам двух атомов. Пример составления электронных и структурных формул:

Можно выделить и другие типы химических связей. Например: σ-связь – сигма - связь, при которой перекрывание электронных облаков происходит вдоль прямой, соединяющей центры взаимодействующих атомов. В молекуле азота (N2) общая электронная пара образуется за счет σ- связи, а 2 общие электронные пары за счет π -связи.
π-связь – пи – связь, боковое перекрывание двух р - орбиталей в двух областях с образованием двух максимумов электронной плотности по обе стороны от плоскости образования сигма - связи. Так изображают образование связей в молекуле азота:
 |
Электроны, находящиеся на внешнем энергетическом уровне атома которые могут принимать участие в образовании химических связей, называются валентными.
Валентность определяется: числом неспаренных электронов, наличием свободных орбиталей и неподеленных электронных пар.
Для определения валентных возможностей атома рассматривают распределение электронов по энергетическим уровням и подуровням для невозбужденных и возбужденных состояний атома. Распределение электронов можно изобразить таким образом:
 |
Неполярная ковалентная связь – связь, образующаяся между атомами неметаллов с одинаковой электроотрицательностью (в молекулах простых веществ).
Полярная ковалентная связь – связь между атомами неметаллов, электроотрицательность которых не сильно различается, при этом происходит смещение общей электронной пары к наиболее электроотрицательному атому (между атомами различных неметаллов).
Ионная химическая связь – связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Она образуется между ионами металлов и неметаллов, электроотрицательность которых сильно отличается друг от друга.
Металлическая химическая связь – связь в металлах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке. Она основана на обобществлении валентных электронов, принадлежащих всем атомам в кристалле.
Водородной связью называют химическую связь, образованную атомом водорода, связанным с атомом другого более электроотрицательного элемента (О, F, N, Сl). Эта связь обусловлена электростатическим притяжением, которому способствуют малые размеры атома водорода. Водородная связь может быть межмолекулярной и внутримолекулярной.
Степень окисления – это условный заряд атома в молекуле, вычисленный согласно предположению о том, что молекула состоит только из ионов. Правила нахождения степени окисления следующие:
1) Алгебраическая сумма степеней окисления атомов в молекуле любого вещества равна нулю,
2) Степень окисления элемента в простом веществе равна нулю,
3) Степень окисления атомов в молекуле сложного вещества может быть выражена отрицательным или положительным числом,
4) Алгебраическая сумма степеней окисления атомов в сложном ионе равна его заряду,
5) Элементы с постоянной степенью окисления: Н +1(кроме гидридов), О –2 (кроме пероксидов) и ОF2 , элементы главной подгруппы 1 группы +1, все элементы 2 группы, кроме Hg +2, алюминий АI +3, фтор F – 1.
Кристаллические решётки могут быть атомными, молекулярными, ионными, металлическими. Ионные кристаллические решетки встречаются у большинства солей, щелочей и некоторых оксидов типичных металлов.
Атомные кристаллические решётки имеют углерод в форме алмаза, кремний, германий, бор.
Молекулярные решётки встречаются у большинства неорганических веществ Н2О (тв), НCl (тв), Н2S (тв) и неметаллов (Н2, N2 (тв), О2 (тв), Cl2 (тв), Р4, S8.
Схему образования ионной связи в NaCl можно представить:
Na +  →Na+[:
→Na+[: 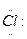 ]-
]-
Образование ковалентной неполярной химической связи в молекуле хлора (Сl2): 
Задания для самоконтроля:
Задание № 1. Составьте структурные и электронные формулы соединений с водородом следующих элементов: а) кремния, б) фосфора, в) брома, г) углерода.
Задание № 2. Определите степени окисления элементов в следующих веществах: а) MgCl2, б) Na2SO4, в) KHSO4, г) NH3, д) KNO2, е) Na2Cr2O7, ж) NaSbO3, з) KMnO4.
Задание № 3. Составьте структурные и электронные формулы следующих веществ:
а) MgCl2, б) Н2S, в) F2, г) NH3, д) O2, е) CO2 .
Определите виды химической связи в данных соединениях.
Не нашли, что искали? Воспользуйтесь поиском: