
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Определить количество редуцирующих cахаров в гидролизате крахмала. Для этого следует использовать йодометрический и глюкозооксидазный методы.
- Йодометрический метод определения редуцирующих cахаров, основанный на способности йода в щелочной среде окислять альдосахара в соответствующие кислоты:
CH2OH–(CHOH)4–CHO + I2 + 3 NaOH →
глюкоза (альдосахар)
→ CH2OH –(CHOH)4–CO(ONa) + 2 NaI + 2 H2O
глюконовая кислота
Избыток йода титруют тиосульфатом натрия:
I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6
I2 + 2e → 2 I2-
2 S2- - 2e → S22-
На анализ отбирают 25 мл полученного ранее нейтрализованного гидролизата и переносят в коническую колбу для титрования. С помощью пипеток вносят 10 мл 0,1 н раствора йода и сразу вслед за этим – 20 мл 0,1 н раствора едкого натра (щелочь вносят по каплям при перемешивании!). Колбу с опытным раствором закрывают бумажным колпачком и оставляют на 15 минут в темном месте.
По истечении 15 минут к раствору добавляют 20 мл 0,1 н раствора серной кислоты, а также по каплям 1% раствор крахмала до тех пор, пока раствор не приобретет насыщенный фиолетовый цвет вследствие взаимодействия крахмала с избыточным непрореагировавшим йодом. Затем полученный раствор титруют 0,1 н раствором тиосульфата натрия до полного обесцвечивания.
Одновременно ставят контрольный опыт с теми же количествами реагентов, с той лишь разницей, что вместо 25 мл гидролизата берут 25 мл дистиллированной воды. Объем 0,1 н раствора йода, пошедшего на окисление глюкозы до глюкуроновой кислоты, определяют по разности объемов тиосульфата натрия, пошедшего на титрование контрольного и опытного растворов. Разница в объемах контроля и опыта должна составлять 0,5-6 мл. Если она меньше 0,5 мл или больше 6 мл, то титрование повторяют с большим или меньшим соответственно объемом гидролизата.
По полученным данным проводят расчет:
Условная крахмалистость (УК) сырья определяется по формуле:
УК =  , % (1.1)
, % (1.1)
где 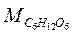 – количество глюкозы в навеске сырья по результатам титрования, соответствующая содержанию крахмала в сырье, г;
– количество глюкозы в навеске сырья по результатам титрования, соответствующая содержанию крахмала в сырье, г;
0,9 – коэффициент пересчета количества глюкозы на условный крахмал;
М – навеска анализируемого сырья с учетом влажности (обычно от 11 до 40 %), г.
Согласно уравнению ниже на титрование 1 грамм-эквивалента глюкозы приходится 1 грамм-эквивалент йода:
С6Н12О6 + 3 NaOH + I2 → C6H11O7Na + 2 NaI + 2 H2O
 М.м. глюкозы = 180 М.м. йода = 2 · 126,9 М.м. глюкозы = 180 М.м. йода = 2 · 126,9
 Х 12,6 мг
(1 мл 0,1 н раствора йода содержит 12,6 мг) Х 12,6 мг
(1 мл 0,1 н раствора йода содержит 12,6 мг)
| Х = 9,008 мг |
Итак, из вышеуказанной пропорции находим, что 1 мл 0,1 н раствора тиосульфата натрия соответствует 9,008 мг глюкозы.
Тогда количество глюкозы в опытном растворе определяется по формуле
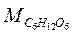 =
=  , г(1.2)
, г(1.2)
где Vк – объем 0,1 н раствора тиосульфата натрия (Nа2S2О3), пошедшего на титрование контрольного опыта, мл;
Vо – объем 0,1 н раствора тиосульфата натрия (Nа2S2О3), пошедшего на титрование опытного раствора, мл;
9,008 – количество глюкозы, соответствующее 1 мл 0,1 н раствора йода, мг;
Vа – 25 мл – объем пробы опытного раствора, отобранной на анализ;
1000 – коэффициент пересчета миллиграмм в граммы;
n – коэффициент пересчета разбавлений.
n =  , (1.3)
, (1.3)
где V1 – объем клейстеризованной пробы (100 мл);
V2 – объем фильтрата, отобранного на кислотный гидролиз (20 мл);
V3 – объем фильтрата с учетом разбавления (100 мл);
V4 –объем гидролизата, отобранного на нейтрализацию (40 мл);
V5 – объем содержимого колбы (50 мл);
V6 – объем пробы, отобранной на титрование (25 мл).
k – поправочный коэффициент 0,1 н раствора йода:
k = Vи/Vтс, (1.4)
где Vи – 10 мл – объем 0,1 н йода, взятого на титрование для определения поправочного коэффициента;
Vтс – объем 0,1 н раствора тиосульфата натрия (Nа2S2О3), пошедшего на титрование 10 мл 0,1 н раствора йода, мл.
Результаты измерений и расчетов заносят в таблицу 2.
Таблица 2 – Результаты эксперимента
| № | Вид сырья | Навеска сырья, М | Vo | Vк | Vк – Vо | k | n | 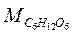
| УК, % |
| Пшеничная мука | 1,5 г | ||||||||
| Крахмал | 1 г |
- Глюкозооксидазный метод определения редуцирующих cахаров
Ферментный препарат на основе глюкозооксидазы применяется в аналитике, благодаря высокой специфичности по отношению к β-D-глюкозе. Даже в отношении своего аномера – α-D-глюкозы – способность фермента к окислению в 150 раз ниже.
 ФАДН2 + О2 → ФАД + Н2О2
ФАДН2 + О2 → ФАД + Н2О2
лактон глюконовой кислоты

|
глюконовая кислота
Фермент представляет собой флавопротеин. На первом этапе ферментативная реакция протекает с образованием лактона глюконовой кислоты и восстановлением простетической группы ФАД. Образовавшийся лактон спонтанно гидролизуется до глюконовой кислоты.
Далее восстановленная форма ФАД передает протоны на кислород с образованием перекиси водорода в количестве, эквимолярном окисленной глюкозе. Присутствующая в растворе пероксидаза катализирует окисление гексацианоферроата перекисью водорода с образованием окрашенного соединения гексацианоферриата калия:
пероксидаза
 K4 [Fe(CN)]6 + O2 + H2O 4K3[Fe(CN)]6 + 4KOH
K4 [Fe(CN)]6 + O2 + H2O 4K3[Fe(CN)]6 + 4KOH
В результате реакции раствор приобретает лимонно-желтый цвет. Интенсивность окраски пропорциональна количеству глюкозы в растворе (гидролизате). Вместо гексацианоферроата калия применяют о‑дианизидин или смесь 4-аминоантипирина с фенолом.
Интенсивность окраски определяют на фотоколориметре. Содержание глюкозы в опытном растворе рассчитывают по формуле (1.5).
Для проведения анализа готовят раствор глюкозооксидазы из стандартного реактива (см. приложение). В три пробирки вносят реактивы следующим образом:
- контрольная проба – 2 мл рабочего раствора глюкозооксидазы;
- опытная проба – 0,2 мл раствора, в котором определяется содержание глюкозы и 2 мл рабочего раствора глюкозооксидазы;
- калибровочная проба – 0,2 мл калибровочного раствора глюкозы (1ммоль/л) и 2 мл рабочего раствора глюкозооксидазы.
Пробирки инкубируют 15 минут при температуре 37 °С или 30 минут при температуре 20 С. Через 5-10 минут после начала инкубации пробирки интенсивно встряхивают. После окончания инкубации определяют оптическую плотность при длине волны 510 нм (470-540 нм, зеленый светофильтр) в кювете с толщиной слоя 10 мм против калибровочной пробы. Окраска устойчива в течение 1 часа после окончания инкубации.
По полученным данным проводят расчет:
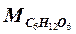 = (Do / Dк) · 10, (1.5)
= (Do / Dк) · 10, (1.5)
где 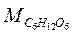 – концентрация глюкозы в опытной пробе, ммоль/л;
– концентрация глюкозы в опытной пробе, ммоль/л;
Do – оптическая плотность опытной пробы;
Dк – оптическая плотность калибровочной пробы;
10 – содержание глюкозы в калибровочной пробе, ммоль/л.
Результаты измерений и расчетов заносят в таблицу 2.
Не нашли, что искали? Воспользуйтесь поиском: