
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Определение теоретического расхода воздуха
для сжигания 1 нм3 газообразного топлива
Количество кислорода, необходимого для окисления выше перечисленных элементов природного газа, определяют из стехиометрических уравнений горения, записанных для одного моля каждого газа.
Методику определения расхода кислорода и, в конечном счете, расхода воздуха удобно и более наглядно рассмотреть на примере твердого топлива. При сжигании 1 моля углерода Ср получаем:
1 моль Ср + 1 моль О2 = 1 моль СО2+ 407 · 103 кДж/моль,
или
12 кг Ср + 32 кг О2 = 44 кг СО2+ 407 · 103 кДж/моль, кг,
или
1 кг Ср +  кг О2 =
кг О2 =  кг СО2+
кг СО2+  кДж/кг углерода.
кДж/кг углерода.
Окончательно
1 кг Ср +  кг О2=
кг О2=  кг СО2 + 33,9 · 103 кДж/кг углерода (9.1)
кг СО2 + 33,9 · 103 кДж/кг углерода (9.1)
Из уравнения (9.1) следует, что для сжигания 1 кг углерода необходимо 8/3 кг кислорода.
Аналогичным образом определяют расход кислорода на сжигание водорода и серы. Конечные формулы этих реакций горения имеют вид:
1 кг Н2 + 8 кг О2 = 9 кг НО2+ 143 · 103 кДж/ кг водорода; (9.2)
1 кг S + 1 кг О2 = 2 кг SO2+ 9,3 · 103 кДж/ кг серы. (9.3)
Количество кислорода, необходимого для сжигания 1 кг твердого топлива, при известном его элементарном составе определяют по уравнению
 =
=  (
( ·Ср + 8 Нр + 1 · S
·Ср + 8 Нр + 1 · S  - Ор), нм3 кислорода/кг топлива. (9.4)
- Ор), нм3 кислорода/кг топлива. (9.4)
Учитывая,что в 1 кг воздуха содержится 23,2% кислорода, а плотность воздуха при нормальных условиях (р н = 101321 Па, t н = 0 ºС) равна ρ = 1,293 кг/нм3, получаем уравнение для определения теоретического расхода воздуха V °, нм3/кг:
V °=  · (
· ( Ср + 8 Нр + S
Ср + 8 Нр + S  - Ор), (9.5)
- Ор), (9.5)
или в конечном виде:
 (9.6)
(9.6)
Аналогичным образом находят уравнение для определения теоретического расхода воздуха при сжигании 1 нм3 газообразного топлива. При сжигании газообразного топлива происходят следующие реакции:
CH4 + 2 O2 = CO2 + 2 H2O + Q;
H2 + 0,5 O2 = H2O + Q;
CO + 0,5 O2 = CO2 + Q,
или в общем виде при сжигании любого углеводорода:
C m H n + 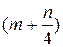 O2 = m CO2 +
O2 = m CO2 + 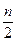 H2O + Q, (9.7)
H2O + Q, (9.7)
где m и n – стехиометрические коэффициенты.
Тогда теоретический расход воздуха, кислород которого окисляет углеводородное топливо (природный газ), можно определить по конечному уравнению
V ° = 0,0478 [0,5 H2 + 1,5 H2S+ (m + 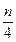 ) C m H n - O2], нм3 возд./нм3 газа. (9.8)
) C m H n - O2], нм3 возд./нм3 газа. (9.8)
Для газообразного топлива, подаваемого в котельную ЛТУ, в соответствии с его элементарным составом уравнение для теоретического расхода воздуха примет вид:
V °= 0,0478 (2 CH4 + 3,5 C2H6 + 5 C3H8 + 6,5 C4H10) нм3 возд./нм3 газа. (9.9)
При определении V ° для газообразного топлива содержание CH4, C2H6, C3H8, C4H10 подставлять в уравнение в процентах.
На практике при сжигании любого топлива воздуха в топку подают несколько больше, чем это теоретически необходимо. Делается это с целью обеспечить наиболее полное сгорание горючих элементов топлива.
Отношение действительного расхода воздуха V д,, нм3/кг, к теоретически необходимому, называется коэффициентом избытка воздуха:
 , (9.10)
, (9.10)
где αт – коэффициент избытка воздуха в топке котлоагрегата (прил. 5); V д – действительный расход воздуха, нм3/нм3; V °– теоретический расход воздуха, нм3/нм3.
Действительный расход воздуха определяется по уравнению
V д = αт ∙ V o, нм3/нм3. (9.11)
Часовой расход воздуха определяется по уравнению
 , нм3/ч, (9.12)
, нм3/ч, (9.12)
где  – часовой расход топлива (см. гл. 8).
– часовой расход топлива (см. гл. 8).
Не нашли, что искали? Воспользуйтесь поиском: