
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
РСNА ақуызымен ДНҚ тізбегінің әрекеттесуі
ДНҚ—полимеразалар (әсіресе бактериялардың ДНҚ-полимераза ІІІ-) нуклеотидтердің аналық тізбекке комплиментарлы синтезделуін қамтамасыз етуімен бірге 31—>5'-экзонуклеазалық-та қызмет атқарады. Соңғы қызметі ДНҚ синтезі барысында дұрыс —комплиментарлы нуклеотидтердің орнына, бұрыс, комплиментарлы емес нуклеотид, жалғанған кезде жүзеге асады. Осы кезде ДНҚ-полимераза бұрыс жұптасқан нуклеотидті «байқап» қалып, оны өсіп келе жатқан 31 ұшынан шығарып (үзіп)
алып тастайды. Осылайша полимеразалар өз жүмыстарын үнемі бақылап отырады
в) Кез келген жаңадан еинтезделген ДНҚ фрагменттері-(ұзын лидерлік не
Оказаки фрагменттері) праймерлерден («РНҚ-ұйытқыдан) басталады. Аналық (матрицалық) тізбек бойымен жылжып отыратын ферменттік кешен келесі ДНҚ фрагментіне жанасқаннан кейін, ДНҚ-полимераза ІІІ ферменті «қыстырушы» РСNА ақуызын ашып, кешенді матрицадан ажыратады және ДНҚ синтезін тоқтатады.

5-сурет синтезделген ДНҚ фрагменттерінің түйісуі (Мушкамбаров, Кузнецовтан, 2003)
Осыдан кейін ДНҚ полимераза І-іске кіріседі. Ол өсіп келе жатқан ДНҚ фрагментінің 3' ұшына жалғанады және 3 белсенділікке ие болады.
Біріншіден ол «алдыңғы» немесе 51—>3'-экзонуклеазалық белсенділікке ие болады, яғни ол бұрынғы ДНҚ тізбегінің «РНҚ-ұйытқысының» (праймер) 51 ұшынан бір-бірлеп нуклеотидтерді алып тастап отырады, ал босаған жерге өз фрагментінің 31 ұшына дезоксинуклеотидтерді жалғайды (ДНҚ-полимеразалық белсенділік).
Сонымен қатар, ДНҚ-полимераза ІІІ-сияқты «артқы» 31—>5' экзонуклеазалық белсенділік арқылы өз жұмысын қадағалауды да «ұмытпайды».
ДНҚ-полимераза-І-қызметі өсіп келе жатқан ДНҚ фрагментінің бұрынғы ДНҚ фрагменттерінің дезоксинуклеотидтерімен түйіскеннен кейін аяқталады.
Эукариоттарда ДНҚ-полимераза ІІІ-қызметін α және σ—ДНҚ полимераза кешені атқарады; бұл жерде 31—5' экзонуклеазалық белсенділік σ -ДНҚ —полимеразаға тиесілі болса, ДНҚ-полимераза І-қызметін, 51—>3' —экзонуклеазалық қызметті ерекше фермент нуклеаза (Н), ДНҚ-полимеразалық белсенділікті (босаған жерді толтыру) β -ДНҚ - полимераза атқарады.
Жоғарыда аталған ферменттер кешені қызметтері нәтижееінде жаңадан синтезделінген әрбір тізбектер бір-бірімен тығыз орналасқан көптеген фрагменттерден тұрады.
Көршілес фрагменттердің бір-біріне жалғануы ДНҚ-лигаза (Л) ферменттері арқылы жүзеге асады.
ДНҚ-полимераза ферменттері сияқты ДНҚ-лигазалар-да нуклеотидтерді фосфодиэфирлік байланыс арқылы байланыстырады. Осылайша ДНҚ молекуласының негізгі бөлігі репликацияланады, ал оның ұштары, яғни теломералық учаскелері, ерекше жолмен репликацияланады. Бұл үдеріске ерекше ферменттер теломеразалар қатынасады.
ДНҚ молекуласының толық репликацияланбайтындығын, яғни теломерлік бөлімдерінің репликацияланбайтындығын, алғаш рет 1971ж. А.М. Оловников айтқан болатын.
Мұның мәні мынада: жоғарыда сипатталған ДНҚ полимеразалық жүйе аналық ДНҚ молекуласының жіпшелерінің 31 ұшын толық репликацияламайды, яғни жаңадан синтезделген ДНҚ тізбектері 51 ұшы жағынан қысқа болады. Себебі әрбір жаңа ДНҚ тізбегі қысқа «РНҚ – ұйытқыдан» (праймер) басталады. Кейін ол ерекше нуклеазалар арқылы алынып тасталады, бірақ босаған учаске дезоксинуклеотидтермен толтырыла алмайды, себебі ДНҚ полимеразалар өз бетінше («РНҚ-үйытқысыз») ДНҚ синтезін бастай алмайды, ол тек полинуклеотидті З1 ұшынан ұзартады. Бұл жерде ондай учаске жоқ, сондықтан жаңа тізбек матрицадан қысқа болады.
ДНҚ молекуласының мұндай ұшын (бір тізбегі ұзын, екіншісі қысқа) үшкір ұшы немесе оверхенга деп аталады.
ДНҚ-ның үшкір үшы тұрақсыз болады, себебі экзонуклеазалар ұзын ұшындағы артық нуклеотидтерді бір-бірлеп алып тастап, ДНҚ ұшын тұйықтайды.
Қалай болғанда да, егер жасушада теломераза болмаса, оның әрбір бөлінуінен кейін хромосома (ДНҚ) қысқарып отырады.
Әрбір репликацияда ДНҚ молекуласы «РНҚ – ұйытқы» ұзындығына сәйкес 10-15 нуклеотидке қысқаруы тиіс болғанымен, шындығында 50-65 нуклеотид жұбына қысқарады. Бұл ДНҚ-полимеразалық кешеннің қасиетіне байланысты болады.
Адамның ядролық ДНҚ-ның 1 молекуласының орташа ұзындығы 120 миллион нуклеотид жұптарына тең десек, жасушаның әрбір бөлінуінде теломераза белсенділігінсіз ДНҚ молекуласы 0,00005%-ға қысқарады екен. Бұл әрине өте аз. Бірақ, табиғатта теломера ұзындығын қалпына келтіріп отыратын тетіктер болмаса түбінде хромосомалар жойылып кеткен болар еді. Тек сондықтан ғана хромосомалар теломерлерінің толық репликацияланбау проблемасының биологиялық маңызы орасан зор. Сонымен қатар, бұл құбылыс ағзалардың қартаю, канцерогенез проблемаларымен де тығыз байланысты.
Толық репликацияланбау проблемалары жасушада қалай шешіледі?
Ғылыми деректер бойынша хромосома ұштарында генетикалық ақпарат болмайтын көптеген арнайы гексонуклеотид (6 нуклеотидтен тұратын) бірізділіктер қайталанып орналасқан.
(51) ЦТААЦЦ... ЦТААЦЦ.... ГГТТАГ... ГГТТАГ... (31)
(31) ГАТТГГ... ГАТТГГ... ЦЦААТЦ... ЦЦААТЦ... (51)
ДНҚ-ның теломерлік бөлімдерінде мыңдаған осындай гексонуклетидтер қайталанады. Олардың жалпы ұзындығы адам эмбрионы жасушаларында 10-15 мың нуклеотид жұптарына тең. Сонымен, хромосоманың екі теломерлік ұшы, адамның ядролық ДНҚ молекуласының ұзындығының 0,02 құрайды.
Теломерлік қайталануларда ешқандай генетикалық ақпарат болмайды, сондықтан да теломерасыз олардың біршама бөлігі түсіп қалған күннің өзінде де геном бірқалыпты қызмет ете береді. Теломерлердің негізгі қызметінің өзі де осы болса керек, яғни олар геномның маңызды (ақпаратты) бөлімін толық репликацияланбаудан қорғап, буферлік қызмет атқарады.
Әйтсе де, теломеразалардан бір жолата бас тартуға да болмайды, себебі жасушаның бөліну үдерісінде күндердің күнінде ДНҚ-ның теломерлік учаскелері қысқарып-қысқарып жойылуы мүмкін. Сонымен қатар, теломерлік учаскелер ерекше, арнайы қызметтер де атқарады, сондықтан ол белгілі бір шекке дейін ғана қысқарады.
Теломералар қызметтері
Теломералар төмендегідей маңызды қызметтер атқарады:
1) механикалық қызметі:
а) Теломералар хромосомалардың ядро матриксіне бекінуіне қатынасады;
б) Теломералар хромосома хроматидаларының ұштарын бір-бірімен
тіркестіреді;
2) Тұрақтандырушы қызметі:
а) Жасушада теломераза болмаған жағдайларда ДНҚ-ның кодтаушы бөлімін толық репликацияланбаудан сақтайды; Егер жасушада теломераза болса, үзілген хромосома ұштарын тұрақтандырады;
3) Гендердің экспрессиялануына әсер етуі.
Теломераға жақын орналасқан гендер экспрессиясы төмен болады (репрессияланған), мұны транскрипциялық үнсіздік немесе сайлинсинг деп атайды.
Теломерлердің айтарлықтай қысқаруы оларға жақын орналасқан гендерді активтендіреді, мысалы Rар 1 не ТҒR 1 гендерінің активтенуі.
4) «Есептеу» қызметі.
ДНҚ-ның теломерлік бөлімдері теломеразасыз жасушаның бөлінуін есептеп отыратын репликометр болып табылады. Жасуша үшін оның қанша рет бөлінгеніне қарағанда, теломера ұзындығының сындарлы деңгейіне дейін қанша рет бөлініп қалғаны маңыздырақ. Сондықтан да теломера- жасушаның теломеразасыз қанша рет бөліне алатынын есептейтін құрылым болып табылады.
Теломера ұзындығы сындарлы деңгейге жеткенде ол өзінің жоғарыда аталған қызметтерін атқара алмайды, сондықтан да жасуша циклы бұзылып өледі.
Сондықтан да, барлық жасушаларда немеее тек эмбрионалдық жасушаларда (ствол жасушаларында), ДНҚ-ның толық репликацияланбаған учаскелері қалпына келуі қажет. Бұл қызметті теломеразалар атқарады. Олар қалай әрекет етеді.
Теломеразалар әрекетінің тетіктері
Теломеразалар әрбір теломералардың G-тізбегін ұзартады. Теломеразалармен 450 нуклеотидтерден тұратын теломеразалық РНҚ байланысқан. Оның ортаңғы қысқа учаскесі 1,5 теломерлік қайталануға комплиментарлы болады (26 сурет).
Осы РНҚ-ның сол жағындағы триплет (АУЦ) ДНҚ-ның G -тізбегенің шеткі теломерлік жартықайталанумен байланысу (гибридтену) үшін пайдаланылады. Қалған гексонуклеотид (ЦЦААУЦ) G -тізбекті 31 ұшынан ұзарту үшін матрица ретінде қызмет атқарады.
Теломеразалар қызметі, өте қызық-таңқаларлық, ол қысқа, жаңадан синтезделген тізбекті ұзартпай, ескі аналық (матрицалық) ұзын тізбекті ұзартады (6-сурет)
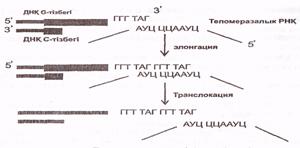
6-сурет. Теломераза әрекетінің тетіктері (Мушкамбаров, Кузнецовтан, 2003)
Аналық (ескі, ұзын) тізбектің 31 ұшына теломераза бірізділікпен бірнеше ондаған, тіпті жүздеген, гексонуклеотидтерді (ГГТТАГ) жалғайды (элонгация, транслокация). Осыдан кейін біршама ұзарған (аналық) тізбек тағы бір Оказаки фрагментінің синтезделуі үшін матрица қызметін атқарады.
Ол жоғарыда сипатталған ДНҚ синтезі сияқты жүзеге асады. Алғаш аналық тізбектің 31 ұшында праймаза «РНҚ ұйытқының синтездейді, сосын ДНҚ-полимераза β теломерлік қайталануларға комплиментарлы дезоксинуклеотидтерді ұйытқыға жалғайды. Фрагменттің өсуі 5'—>3' бағытында жүреді, ал оның аяқталуы алдыңғы фрагменттің 51 ұшымен түйіскенде ғана жүзеге асады. Синтезделген фрагменттің ДНҚ тізбегіне жалғануын ДНҚ-лигаза қамтамасыз етеді. Экзонуклеаза жаңа тізбектегі «РНҚ-ұйытқыны» алып тастайды. Нәтижеде ДНҚ қос тізбегі бұрынғы ұзындығына ие болады.
Дәріс
Тақырыбы: ДНҚ транскрипциясы немесе РНҚ синтезі
Жоспар: 1. Жалпы мәліметтер
2. Транскрипцияның жалпы сипаттамасы
3.Транскрипция факторлары
ДНҚ молекуласында генетикалық ақпарат болатыны белгілі, ол: -ағзаның барлық акуыздары және РНҚ молекулалары туралы ақпарат; -онтогенез барысында осы ақпараттың жүзеге асуының реті туралы ақпарат.
Адам ағзасының барлық дене жасушаларында хромосома жиынтығы бірдей (46) болғандықтан олардың бәрінде бірдей генетикалық ақпарат болады.
Бұл жағдай, яғни генетикалық эквиваленттілік, диплоидты ағзаларды клондауға мүмкіндік береді.
Өзімізге белгілі ДНҚ репликациясы нәтижесінде генетикалық ақпарат екі еселенеді және олар жаңадан түзілген жасушаларға тепе-тең мөлшерде беріледі.
Бұдан басқа, генетикалық ақпарат экспрессияланады яғни әрі қарай жүзеге асады.
Белгілі бір ақуыз молекуласының құрылымы туралы ақпараттың экспрессиялануы 2 кезеңнен тұрады: а) транкрипция —жасуша ядросында а-РНҚ түзілуі; б) трансляция —аРНК, ақпараты негізінде рибосомаларда ақуыз молекуласының синтезделуі.
Транскрипция дегеніміз — ДНҚ молекуласындағы генетикалық ақпараттың РНҚ молекуласына көшіріліп жазылуы, яғни РНҚ синтезделуі болып табылады.
Егер ДНҚ репликациясы жасушаның бөлінуіне байланысты болатын болса, яғни тек бөлінуші жасушаларда байқалатын болса, транскрипция үдерісі барлық ядролы жасушаларда, бөлінетін және белінбейтін, байқала береді.
Бөлінетін жасушаларда ол митоздық циклдың кез-келген уақытында жүреді және ДНҚ молекуласының бір учаскесінің транскрипциялануы көп рет қайталанып жүруі мүмкін.
Транскрипция немесе РНҚ синтезі үшін құрылыс материалдары болып рибонуклеозидтрифосфаттар (рАТФ, рГТФ, рЦТФ, рУТФ) саналады. РНҚ тізбегіне қосылған кезде олар 2 фосфат қалдығын пирофосфат күйінде бөліп шығарып, босаған энергияны нуклеотидтер арасындағы фосфодиэфирлік байланыстың түзілуіне жұмсайды.
Еркін рНТФ —> рРНҚ тізбегіндегі қалдығы +пирофоефат
РНҚ синтезі промоторлық учаскеден басталып терминаторлық учаскемен аяқталады. РНҚ синтезі жүруі үшін ДНҚ молекуласының кем дегенде 2 өрімінде ДНҚ жіпшелері бір-бірінен ажырасулары қажет, ширатылған күйінде транскрипция жүрмейді.
РНҚ синтезі ассиметриялық құбылыс, яғни бір-бірінен ажырасқан ДНҚ жіпшелерінің тек біреуі ғана РНҚ синтезі үшін матрица (қалып) қызметін атқара алады. РНҚ синтезі консервативтік құбылыс, яғни транскрипция аяқталғаннан кейін ДНҚ молекуласы ширатылып, бастапқы күйіне келеді.
РНҚ синтезін РНҚ-полимераза — ферменті өз бетінше жүргізеді. Яғни ешқандай ұйытқының қажеті жоқ.
Транскрипция өнімі болып жетілмеген РНҚ-лар: пре-аРНҚ, пре-тРНҚ, пре-рРНҚ-лар саналады. Олар ядрода пісіп жетіледі (процессинг).
Гендердің экспрессиялануына көптеген ақуыздар әсер етеді. Соңғы жылдары транскрипциялық фактор қасиетіне ие көптеген ақуыздар анықталды. Олар бір-бірімен, не ДНҚ молекуласының реттеуші учаскелерімен (промотор, энхансерлер), не басқа да заттармен (лиганда) әрекеттесіп гендердің белсенділігіне әсер етеді.
Дәріс
Тақырыбы: ДНҚ молекуласының реттеуші
учаскелерімен байланысатын ақуыздар
ДНҚ-мен байланысатын ақуыздар саны өте көп. Құрылымдарына қарай оларды бірнеше топқа топтастырады:
а) «Ширатпа-бұрылым-ширатпа» мотивтері болатын ақуыздар.
Бұл ақуыздардың ДНҚ-ны танитын, онымен байланысатын учаскелері ілмек арқылы қосылған екі α- ширатпадан тұрады. Олардың біреуі белгілі бір нуклеотидтер бірізділігімен спецификалық әрекеттесіп, ДНҚ молекуласымен тікелей байланысады
(7-сурет).

Ақуыздың екі субъединицасы
7-сурет. «Ширатпа-бұрылым-ширатпа» мотиві болатын ақуыздың ДНҚ-мен әрекеттесуі (Мушкамбаров, Кузнецовтан, 2003)
б) Гомеодомендері болатын ақуыздар.
бұларға эукариоттардың эмбриональдық дамуына жауапты гомейотикалық гендердің өнімдері жатады. Осы ақуыздар арқылы кейбір гендерді іске қосып, кейбіреулерін істен шығарып ағзалардың дамуы реттелінеді (8-сурет).
ГОМЕОДОМЕНДЕР

8-сурет. Гомеодомендік ақуыздар (Мушкамбаров, Кузнецовтан, 2003)
Бұл ақуыздардың ерекшелігі-гомеодомендер деп аталатын біртипті домендердің болуы.
Гомеодомен, шамамен, 60-тай аминқышқылдарынан құрылған, құрылысы жағынан прокариоттардың ақуыз-репрессорларына ұқсас болады.
в) «Мырыш саусақтары» болатын ақуыздар.
Бұл ақуыздардың саусақтерізді құрылымдары болады. Олар мырыш атомының 2 цистеин және 2 гистидин аминқышқылдарының қалдықтарымен 4 байланыс пайда ету арқылы тұрақтанады (9-сур).
ДНҚ

"Мырыш саусақтары"
«Мырыш саусақтары бар» ақуыздардың ДНҚ мен әрекеттесуі (Мушкамбаров, Кузнецовтан, 2003)
Саусақтың сыртқы бетінде ДНҚ-ның белгілі бір нуклеотид бірізділігін арнайы танитын α-ширатпа орналасқан. Саусақтардың саны әртүрлі ақуыздарда түрліше болады.
Бұл топқа эукариоттардың көптеген реттеуші ақуыздары, атап айтқанда стероидтық гормондардың жасушаішілік ақуыз-рецепторлары жатады.
г) Лейцин «ілдіргіші» бар ақуыздар.
Бұл топқа бір-бірімен Лейцин қалдықтары арасындағы гидрофобтық байланыстар арқылы қосылған 2 субъединицадан (бөлшектен) тұратын ақуыздар кіреді.
ДНҚ-мен байланысатын учаскеде негіздер қасиетіне ие аминқышқылдар-аргинин және лизин көптеп кездеседі (30-сурет).
Бұл топқа эукариоттардың көптеген транскрипциялық факторлары кіреді.
Дәріс
Тақырыбы: Транскрипцияның жалпы факторлары
Жоспар: 1. р-53 ақуызы-транскрипция факторы
2. Транскрипция тетіктері (механизмдері)
Транскрипцияның жалпы факторлары РНҚ полимераза ферментінің промотормен байланысуын қамтамасыз ететін ақуыздар.
10-сурет. Леицин «ілдіргіші» бар ақуыздың ДНҚ мен әрекеттееуі
(Мушкамбаров, Кузнецовтан, 2003).

Бұл ақуыздардың өздеріде промотормен байланысады.
Промоторлық учаскеде бокстар деп аталатын ерекше нуклеотидтер бірізділігі кездеседі, мысалы эукариоттарда ТАТА бокс жиі кездеседі, сонымен бірге сиректеу ГЦ-, ЦТ-бокстары да белгілі. Әртүрлі дромоторларда олардың орналасу реті түрліше; кейбір жағдайларда ГЦ-бокс, ТАТА-боксқа дейін орналасса, екінші біреулерінде керісінше.
Промотордың ТАТА-боксымен алғаш ТВР-ақуыз байланысады. Бұл бірнеше ТАҒ-ақуыздардың жалғануын инициациялайды.
Бұл ақуыздар (ТВР және ТАҒ ақуыздары) - транскрипцияның жалпы факторлары деп аталады, себебі олар барлық жасушаларда кездеседі және көптеген гендердің экспрессиялануы үшін міндетті түрде қажет. Осы ақуыздар кешенін ТҒ ІІ Д деп те атайды.
Осы ақуыздар РНҚ-полимераза ІІ-нің промотормен байланысуы
үшін қажет. Промотормен байланысқан ақуыздар кешенін негізгі инициаторлық кешен деп атайды. ТҒІІД дан басқа ТҒІІА, ТҒІІВ, ТҒІІЕ, ТҒІІН деп аталатын транскрипсцияның жалпы факторлары да белгілі. Олар әртүрлі промоторлармен байланысады (11-сурет).

Транскрипцияның негізгі инициаторлық кешені (Мушкамбаров, Кузнецсовтан, 2003)
р-53 ақуызы жасушаның көптеген құбылыстарын реттеуге қатынасады және оның қызметі сан алуан:
1. Жасуша құрылымдарының бұзылыстарына жауап ретінде р-53,
не оның гені активтенеді.
2. р-53 ақуызы 3 топ гендердің белсенділігін реттейді:
а) Р-21, GAAD 45 т.б. жасуша бөлінуін тоқтататын гендерді
активтеңдіреді;
б) апоптозды іске қосатын ВАХ, КіІІег/ DR5, РІG т.б. гендерді
активтендіреді;
в) апоптозды тежейтін BCL2, RELA гендерін репрессиялайды;
г) ангиогенезді тежейтін TSP1, ВАІІ т.б. гендерді активтендіреді
яғни ақуыз р-53 көмегімен жасуша өз құрылымдарының бұзылыстарына төмендегідей жауап қайтарады:
-митоздық циклдың белгілі бір сатысында оның әрі қарай бөлінуін тоқтатып бұзылыстарды жөндеуге мүмкіндік жасайды; -немесе әрі қарай бөлінуін мүлдем тоқтатып жасуша қартаю кезеңіне өтеді;
-немесе апоптоз іске қосылады да жасуша өліп жойылады.
Р-53 молекуласы 392 аминқышқылдарынан құрылған және көлемі, қызметтері әртүрлі 6 доменнен тұрады (12-сурет).
Орталық домен ең үлкен домен (200 аминқышқылы кездеседі) ген нысананың энхансерлерін танып білу қызметін атқарады және олармен байланысады.
Ақуыздың N ұшында N ұшы домені транскрипцияның жалпы факторларымен, яғни ТҒІІD кешенімен әрекеттеседі.
Бұл байланысулар басқа да көптеген факторлардың (домендердің) бақылауында болады.
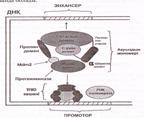
12-сурет. Р-53 ақуызының құрылысы (Мушкамбаров, Кузнецовтан, 2003)
N доменде ақуыз—ингибитор Мdm -2-мен байланысатын локус болады. Ол ТҒIID кешенін бастырмалайды. Осы жерде серинтрионин аминқышқылдары қалдықтары көптеп кездеседі және олар протеинкиназалармен фосфорланады. Бұл киназалар ДНҚ молекуласының құрылысы бұзылған кезде активтенеді де, Мdm 2-ингибиторына әсер етіп, оны пассив күйіне көшіреді, нәтижеде 14-домен ТҒIID кешенімен әрекеттесу қабілетіне ие болады.
Орталық доменнің энхансерлермен әрекеттесуі де бақылауда болады, ол модификациялану арқылы жүзеге асады, бірақ бұл кезде орталық домен емес С-ұшы-домені модификацияланады және ол көптүрлі болып келеді: фосфорлану, ацетильдену, гликозилдену т.б.
Егер С-ұшы-домені модификацияланбаса, орталық домен ДНҚ-нысанамен (энхансерлер) әрекеттесе алмайды.
Жоғарыда айтылғандай Р-53 ақуызы кейбір гендердің—ВCL2, RELA, әрекетін репрессиялайды. Бұл қызметті С-ұшы домені атқарады. Бұл кезде ол ТҒIID кешенімен байланыеып, оның белсенділігін тежейді.
Р-53 ақуызының басқа да домендері белгілі: α-ширатпалы домен С-доменге дейін орналасқан. Оның қызметі-Р-53 ақуызын тетрамерлік кешен күйіне көшіріп оның белсенділігін қалыптастыру болып табылады.
Орталық жөне α-ширатпалы домендер арасында линкерлік (байланыстырушы) учаске орналасқан. Ол енді ғана синтезделген Р-53 ақуызының сцитоплазмадан ядроға өтуі үшін қажет.
Транскрипция тетіктері (механизмдері)
Транскрипцияның ең алғашқы және маңызды кезеңі-оның инициациясы: РНҚ-полимеразаның промотормен байланысуы және алғашқы нуклеотидтераралық (фосфодиэфирлік) байланыстың түзілуі.
РНҚ полимераза мен промотордың байланысуы қалайша жүзеге асады?
Бактерияларда РНҚ полимераза промотор құрамындағы белгілі бір нуклеотидтер жұптарының бірізділігін тікелей таниды, мыс: Прибнов боксын. Бактерияның РНҚ полимераза ферментінің коферменті 3 түрлі субъединицадан - αββ1, қүрылған тетрамер болып табылады. Ол өздігінен промотормен байланыса алмайды, ал егер оған ерекше ақуыз- σ -фактор жалғанса онда σ -фактордың қатынасуымен РНҚ-полимераза ферменті промотордың Прибнов боксын танып, онымен байланысады да транскрипцияны бастайды (13 сурет).

13-сурет. Бактерия ДНҚ-сының транскрипциялану жобасы (Мушкамбаров, Кузнецовтан, 2003)
Эукариоттарда промотормен көптеген ақуыздар байланысады, мыс: ТҒІІD, ТҒІІА, ТҒІІС, ТҒІІЕ, ТҒІІН кешендері, сонымен қатар ген транскрипңиясының инициасиялауы үшін осы геннің энхансерлерімен байланысатын басқа да транскрипция факторлары (мыс: ақуыз Р-53) қажет.
РНҚ полимераза промотормен байланысып, ДНҚ молекуласының локальды денатурациялануын, яғни ДНҚ тізбектерінің 1,5-2 ширатпа ұзындығында бір-бірінен ажырауын туғызады. Осылайша транскрипциялық «көзше» пайда болады және «көзшедегі» ДНҚ-ның матрицалық тізбегінде орналасқан нуклеотидтердің р →НМФ-тармен комплиментарлы жұптасуына мүмкіндік туады.
Жаңадан синтезделуші РНҚ тізбегіне алғашқылардың бірі болып пуриндік нуклеотид-АТФ не ГТФ қосылады жөне ол өзінің 3 фосфат қалдығын сақтап қалады. Содан кейін екінші нуклеотидпен алғашқы 5'-3-фосфаттық байланыс түзіледі. Осыдан кейін бактерияларда б-фактор РНҚ-полимеразамен байланысын үзіп, түсіп қалады.
Инициациядан кейінгі кезең - элонгация: синтезделуші пре-РНҚ тізбегінің жайлап ұзаруы терминациялық учаскеге дейін жалғасады. РНҚ синтезінде 1 секундта шамамен 30 нуклеотид жалғанады.
Жалпы алғанда транскрипция қателіксіз жүреді, себебі ол матрицалық (қалып), комплиментарлық принциптерге негізделінеді, бірақ кейде 2х104 нуклеотидтен біреуі қате жұптасуы мүмкін. Бұл қателіктер мутацияға алып келеді, сондықтан олар дер кезінде эндонуклеазалар арқылы жөнделіп отырады.
Транскрипцияның соңғы кезеңі терминация, немесе транскрипцияның аяқталуы. Терминацияға сигнал болып геннің аяқ жағындағы ГЦ-ға бай учаскелері саналады. Г-Ц байланысы (3 сутектік байланыс) мықты, берік болғандықтан ДНҚ-ның осындай учаскесінің локальды денатурациялануы (екі жіпшесінің ажырасуы) қиындай түседі. Бұл РНҚ—полимераза ферментінің жылжуын баяулатады және транскрипцияның тоқталуына (аяқталуына) алып келеді. Синтезделген пре-РНҚ-ның ДНҚ молекуласынан босанып шығуын бактерияларда ерекше ақуыз- Rһо-фактор қамтамаеыз етее, эукриоттарда жаңадан синтезделген пре-РНҚ-ның аяқ жағындағы ГЦ-бай учаскесіндегі нуклеотидтер арасындағы әрекеттесулер салдарынан пайда болатын «ілмекшелер» («шпильки») атқарады.
Дәріс
Тақырыбы: Транскрипцияның алғашқы өнімдері
Жоспар: 1. Транскрипцияның алғашқы өнімдері
2.Пре-РНҚ-лардың пісіп жетілуі— процессинг
Транскрипция нәтижесінде эукариоттарда жетілмеген пре-РНҚ (пре-аРНҚ, пре-тРНҚ, пре-рРНҚ) синтезделінеді, себебі эукариоттар генінің құрылысы бактерияларға қарағанда күрделірек, яғни ол экзон-интрондық құрылысқа ие болады және транскрипңия кезінде пре-РНҚ-ларда экзондық-интрондық учаскелері түгел көшіріліп жазылады (34-сурет).
а) пре-аРНҚ-жетілген а-РНҚ-ларға қарағанда әлде қайда ұзын болады, себебі олардың құрамына спейсерлер (реттеуші, құрылымдық қызметтер атқаратын ДНҚ учаскелері), мағыналы ДНҚ учаскелері-
экзондар, мағынасыз учаскелері-интрондар кіреді. Сондықтан да пре-РНҚ-ларды кейде гетерогендік ядролық РНҚ (гя-РНҚ) деп те атайды.
пре а-РНҚ-лардың келесі ерекшелігі оның 5' ұшында «қалпақшаның» (КЭП), 31 ұшында-поли (А)-фрагменттің болмауы.
б) рРНҚ-ның кластерлі 3 гені біртұтас транскрипцияланады және синтезделген пре-рРНҚ немесе 45S РНҚ-құрамында жетілгенүш түрлі рРНҚ-ға 18S, 5.8S, 28S РНҚ-сәйкес келетін бірізділіктер
болады. Бұл бірізділіктер спейсерлермен бөлінген, бірақ онда интрондарболмайды. Сонымен қатар, бұл жерде жетілген рРНҚ-ларда кездесетінмодификацияланған нуклеотидтерде болмайды.

14-сурет Пре-а РНҚ және пре-р РНҚ (Мушкамбаров, Кузнецовтан, 2003)
в) Барлық пре-РНҚ-лардан ерекше пре-тРНҚ—лар тек жетілген бірізділіктерді қамтиды. пре-тРНҚ молекуласының сырт пішіні «жөке ағашының жапырағына» («кленовый лист») ұқсас үшқұлақты болады, бірақ оның жетілген тРНҚ молекуласынан төмендегідей ерекшеліктері белгілі (15-сурет).
-молекуланың екі ұшында және ортасында қосымша бірізділіктер болады;
-минорлық (модификацияланған) нуклеотидтер болмайды;
-акцепторлық ілмекше (ЦЦА) толық қалыптаспаған;
-антикодон өз орнында емес, басқа жерде орналасқан.
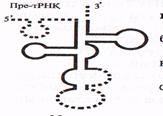
пре-РНҚ молекуласының пісіп жетілуі (процессинг) 3 кезеңге бөлінеді:
- кейбір нуклеотидтердің алынып тасталуы;
- кейбір нуклеотидтердің жалғануы;
- олардың модификациялануы;
Артық нуклеотидтердің алынып тасталуы ерекше нуклеазалар арқылы жүзеге асады. Экзонуклеазалар тізбектің бір ұшынан (31 не 51) бір — бірлеп нуклеотидтерді алып тастайды, ал эндонуклеазалар тізбекті бөлшектеп оны жеке-жеке фрагменттерге беледі.
а) Нуклеазалар тізбек ұштарынан «артық» нуклеотидтерді үзіпотырады. Мысалы, пре-РНҚ-ның 51 ұшында үнемі АТФ не ГТФ,ал 31 ұшында ГЦ—бай учаскелері болады. Олар транскрипция
үдерістерінде маңызды рөл атқарады, ал жетілген күйінде олардыңқажеті жоқ, тіпті олар өздерінің қызметтерін атқаруға кедергі келтірген болар еді, сондықтан да олар алынып тасталады.
б) сонымен бірге тізбек ұштарынан спейсерлік нуклеотидтербірізділігі үзіліп алынып таеталады. Бұл-эндонуклеазалардың қатынасуымен жүреді.
в) 45S-пре-рРНҚ және гистондық пре-аРНҚ-лар эндонуклеазаларарқылы жеке РНҚ тізбектеріне кесіледі.
г) пре-тРНҚ және барлық пре-аРНҚ-лардың интрондықбірізділіктері кесіліп алынып тасталады. Сол сияқты, экзондықбірізділіктер түтас бір тізбекке жалғанады, оны сплайсинг деп атайды. Мұның іске асырылуы үшін тек қана эндонуклеазаларемес, лигазалар да қажет.
Сонымен, пре-РНҚ молекуласының пісіп жетілуі (процессинг) барысында оларға көптеген нуклеотидтер транскрипциясыз байланысады (жалғанады).
пре-аРНҚ-ның 51 ұшына «қалпақшаның» (КЭП) 7-метилгуанин және басқа да 3-4 нуклеотидтері қосылып жалғанады, ал 31 ұшына 200-дей нуклеотидтерден тұратын поли (А)-фрагмент қосылады. Бұл үдерісті полиаденилатполимераза ферменті катализдейді.
пре-тРНҚ молекуласының 31 ұшына 3 нуклеотид (Ц, Ц, А) бірінен кейін бірі жалғанып, акцепторлық учаске пайда етеді.
пре-РНҚ-ның пісіп жетілуінің (процессинг) маңызды құбылысы олардың құрамында модификацияланатын нуклеотидтердің пайда болуы. пре-а-РНҚ-да «қалпақша» нуклеотидтерінің рибоза қалдықтарының метилденуі байқалады.
Пре-т-РНҚ-да модификациялану көптүрлі болып келеді, мысалы: уридин қалдығы тотықсызданады (дигидроуридин пайда болғанға дейін), басқалары-изомерленеді (псевдоуридин), үшінші біреулері -метилденеді (метилуридин). Аденозиннің кейбір қалдықтары дезаминденіп инозинге айналады, соңғыларының (инозин) кейбіреулері тағы да метилденеді (метилинозин).
Жоғарыда сипатталған құбылыстар ядрода бірнеше пісіп жетілген РНҚ молекулаларының пайда болуына алып келеді, мысалы:
а) 4 түрлі рРНҚ-ның: 28S рРНҚ; 18S рРНҚ; 5.8S рРНҚ; 5SрРНҚ;
б) бірнеше ондаған т-РНҚ-ның (әрбір 20 аминқышқылына 1-4 ке дейін);
в) мыңдаған аРНҚ молекулаларының
Дәріс
Тақырыбы: а-РНҚ-лардың ыдырауы
Жоспар: 1.Бактериялардың а-РНҚ-ның 51 ұшынан ыдырауы
2. Эукариоттар а-РНҚ-ның 31 ұшынан ыдырауы
Бактериялар а-РНҚ-сының ыдырауы 51 ұшынан басталып а-РНҚ синтезделу (5'-3') бағытында жалғасады. Сонымен қатар, бактерияларда ядро болмайды, ал а-РНҚ-лары әжептеуір ұзын, полицистронды болып келеді.
Осылардың бәрі, а-РНҚ-ның бір тізбегінің бір мезгілде 3 түрлі үдерістерге қатынасуына мүмкіндік береді:
- ДНҚ молекуласынан өзінің (а-РНҚ) пайда болуына (транскрипция);
- рибосомаларда трансляциялануына, яғни қызмет етуіне;
- өздігінен ыдырауына, яғни 51 РНҚ-азалар әсерлерінен 51
ұшының біртіндеп қысқаруына (16-сурет).

16-сурет. Бактериялар а-РНҚ-ның транскрипциялану, трансляциялану және ыдырау үдерістерінің қабаттасып келу жобасы. (Мушкамбаров, Кузнецовтан, 2003)
Эукариоттар а-РНҚ-ның тіршілік ұзақтығы 10 минуттан (қысқа тіршілік ететін а-РНҚ) 2 тәулікке дейін созылады. Қысқа уақыт тіршілік ететін а-РНҚ-ларға реттеуші ақуыздар а-РНҚ-лары жатады. Эукариоттар а-РНҚ-сы моноцистронды болып келеді. Олардың ыдырауы бактериялардағыдай 51 РНҚ азалар көмегімен емес, 3' РНҚ-азалар арқылы жүзеге асады, яғни әдетте ол 31-ұшындағы 200 нуклеотидтерден құрылған поли-(А)-фрагменттен басталады.
Демек, бұл фрагмент ДНҚ теломералары сияқты буферлік қызмет атқарады. Оның ұзындығының жайлап қысқаруы белгілі бір уақытқа дейін нуклеин қышқылының маңызды, кодтаушы бөлімдерін ыдыраудан сақтайды. а-РНҚ-ның поли- (А)-фрагменті 31 РНҚ-аза ферменті әсерлерінен үнемі қысқармайды, оның қызметтік белсенділігіне сай, мезгіл-мезгіл қысқарады. а-РНҚ-ның әрбір трансляциясы аяқталғаннан кейін рибосома поли-(А)-фрагменттен 10-15 нуклеотидтерді үзіп алып тастайды. Осы фрагментте 50-ге жуық нуклеотидтер қалған кезде а-РНҚ РНҚ-аза әсеріне ілігіп тез ұшырайды.
Бір а-РНҚ 10-15 ретке дейін трансляциялана алады, себебі 15 рет трансляцияланғанда поли-(А)-фрагмент 150-ге дейін нуклеотидтерінен айырылады (15x10=150) және оның ұзындығы сындарлы ұзындыққа-50 нуклеотидке дейін жетеді.
Поли-(А)-фрагменттің ыдырауы мен транслцңия арасындағы байланысты қалай түсіндіруге болады?
Оның тетігі (механизмі) төмендегідей болуы мүмкін (37-сурет).
Оған сәйкес, поли-(А)-фрагмент өзінің 31 ұшымен а-РНҚ-ның белгілі бір трансляцияланатын учаскесімен әрекеттсеіп ілмек пайда етеді және онымен сутектік байланыс арқылы байланысып қос тізбектік құрылым түзеді. Осындай қос тізбекті күйінде поли-(А)-фрагменттің 31 ұшы 3'-РНҚ-аза ферментінің әсеріне берілмейді.

17-сурет. Поли-(А)-фрагменттің 10-15 нуклеотидтер үзіліп шығарыла-
қысқару және ыдырау жобасы (Мушкамбаров, Кузнецовтан, 2003)
Аталған учаске арқылы рибосома өткен кезде шамалы уақытқа дейін ілмек үзіледі және а-РНҚ-ның 31ұшы РНҚ-аза әсеріне ілігіп бір-бірлеп 10-15 нуклеотидтер үзіліп шығарылады.
Поли-(А)-фрагментте 50 нуклеотид қана қалған кезде а-РНҚ-ның З1 ұшында ілмек пайда бола алмайды және РНҚ-аза ешбір кедергісіз а-РНҚ-ны түгелдей ыдыратады.
Дәріс
Тақырыбы: Ақуыз биосинтезі (трансляция)
Жоспар: 1. Генетикалық код және оның қасиеттері
2.Генетикалық кодтың негізгі қасиеттері
3. Ақуыз биосинтезі немесе трансляция тетіктері
Жоғарыда айтқанымыздай тұқым қуалаушылық ақпарат ДНҚ молекуласында генетикалық код күйінде жазылған.
Генетикалық код (кодтау) -дегеніміз тұқым қуалаушылық ақпараттың, яғни 20 аминқышқылдар туралы ақпараттың, ДНҚ молекуласындағы 4 нуклеотидтер (А,Г,Ц,Т) арқылы қысқаша жазылу, сақталу және жүзеге асу жүйесі болып табылады.
ДНҚ молекуласының екі тізбегі бір-бірінен қызметтік ролі жағынан ерекшеленеді: олардың біреуі-кодтаушы немесе мағыналы, ал екіншісі -матрицалық (қалып) тізбектер болып табылады. ДНҚ мағыналы тізбегі: (51) - ТТЦ-АГТ-ЦАГ-ГАЦ-ГАТ-АЦГ- (З1) ДНҚ матрицалық тізбегі: (З1) - ААГ-ТЦА-ГТЦ-ЦТ-ЦТА-ТГЦ- (51)
Транскрипция 4-
а-РНҚ (51)- УУЦ-АГУ-ЦАГ-ГАЦ-ГАУ-АЦГ- (31)
Трансляция 4, Полипеитид тізбегі: (NН2)-Фен -Сер -Глн -Асп -Асп -Тре -(СООН)
ДНҚ молекуласындағы ақпараттың өлшем бірлігі болып триплет саналады, яғни үш нуклеотид бір аминқышқнлын анықтайды. Сонымен генетикалық код (кодон) 1 нуклеотидтен көп болуы тиіс, себебі егер кодон 1 нуклеотидтен тұрады десек, 4 нуклеотид 4-ақ кодонды қалыптастырар еді, ал аминқышқылдар саны 20, демек 4 кодон жеткіліксіз. Ал егер генетикалық код 2 (жұп) иуклеотидтен тұрады десек, 4 нуклеотидтерден 16 әртүрді жұптарды (42=16) жұптастыруға болар еді, бірақ 16 кодон да 20 аминқышқылдары үшін жеткіліксіз.
1954 жылы американ ғалымы Г.Гамов теория күйіңде генетикалық код (кодон) 3 нуклеотидтерден (триплетті) тұруы мүмкін деген болжам айтқан. Шынында да 4 нуклеотидтерден (А,Г,Ц,Т) 64 әртүрлі үштіктерді (43=64) құрастыруға болады және 64 кодон 20 аминқышқылдары үшін әбден жеткілікті. Мүмкін кодон 4 нуклеотидтен тұратын шығар, бұл жағдайда 4 нуклеотидтен (А,Г,Ц,Т) 256 әртүрлі үштіктерді құрастыруға болар еді, бірақ 20 аминқышқылы үшін осыншама көп (256) кодон болады деп болжамдау ақылға қонбайды, себебі табиғат өзінің дамуында үнемі үнемді жолдарды таңдап отырған.
1961 жылы Ф.Крик генетикалық код триплетті (3 нуклеотидтен тұратындығын) болатынын тәжірибе жасап дәлелдеді, яғни лабораториялық жағдайда 3 Урацилдің (УУУ) фенилаланин аминқышқылын анықтайтынын көрсетті. Ал, 1964 ж. М. Ниренберг, Е. Очао, Х.Хорана т.б. еңбектерінің нәтижесінде барлық 64 кодонның мағынасы анықталып, олардың негізгі қасиеттері белгілі болды.
64 кодонның 61- машналы кодондар, яғни 20 аминқышқылының біреуін анықтайды, ал 3-еуі (УАА, УАГ, УГА) мағынасыз кодондар, яғни ешқандай аминқышқылдарын анықтамайды, олар ақуыз синтезінің аяқталуын бақылайды, еондықтан оларды-«стоп кодондар», «кодон-терминаторлар» деп те атайды.
ДНҚ молекуласының кодтарына сәйкес келетін а-РНҚ триплеттерін кодондар деп атайды.
1. Генетикалық код әмбебапты болады, яғни кодондар барлық тірі ағзаларда бірдей АК-рын анықтайды;
2. Генетикалық код коллинеарлы (сәйкес) болады, яғни нуклеин қышқылдарындағы (ДНҚ, РНҚ) нуклеотидтер бірізділігі полипептид молекуласындағы аминқышқылдар бірізділігіне сәйкес болады;
3. Генетикалық код артық (вырожденный) болады, яғни әрбіраминқышқылы 2-6 кодон арқылы анықталады, тек метионин және триптофан аминқышқылдары бір ғана кодон арқылы анықталады.
Бір аминқышқылдарының кодондары бір-бірінен үшінші (соңғы) нуклеотидтері арқылы ерекшеленеді, мысалы: серин кодондары-УЦУ, УЦЦ, УЦА, УЦГ.
Құрылысы жағынан ұқсас аминқышқылдардың кодондары да ұқсас болады, яғни олардың екі нуклеотиді бірдей, мысалы: Аспарагин, Глутамин сияқты ұқсас аминқышқылдардың кодондарының алғашқы нуклеотидтері бірдей (ГАУ, ГАЦ, Г, ГАГ).
4) кодондар а-РНҚ тізбегінде бірінен кейін бірі үзіліссіз-үтірсіз, нүктесіз, бірізділікпен орналасады;
5) кодондар а-РНҚ тізбегінде бірін-бірі бастырмаламай орналасады;
6) кодондар нақтылы болады, яғни әрбір мағыналы кодондарға бір аминқышқылы сәйкес келеді;
7) Кодондар триплетті (үш ерімді) болады.

Ала-аланин, Арг - аргинин, Асн -аспарагин, Асп -аспарагин қышқылы; Вал -валин, Гис - гистидин, Гли -глицин, Глн- глутамин, Глн -глутамин кышқылы, Иле -изолейцин, Лей - лейцин, Лиз - лизин, Мет - метионин, Про -пролин, Сер -серин, Тир - тирозин, Тре - треонин, Три -триптофан, Фен -фенилаланин, Цис - цистидин, Стоп - стопкодон.
ДНҚ молекуласындағы тұқым қуалаушылық ақпараттың экспрессиялануының келесі кезеңі —ақуыз биосинтезі немесе трансляция.
Ақуыз биосинтезі жасушаиың тіршілігі үшін ете қажет, себебі жасушаның тіршілік үдерістерінде ақуыз молекуласы түрліше қызметтер атқарып, әртүрлі биохимиялық реакцияларға қатынасып, ыдырап жойылып отырады. Ал олардың орнын толтыру ақуыз молекуласының жаңадан синтезделуі арқасында жүзеге асады.
а-РНҚ молекуласындағы нуклеотидтер бірізділігінде жазылған ақпараттың коллинсарлы полипептид молекуласының аминқышқылдары ретіне берілуін транслясц немесе ақуыз биосинтезі деп атаймыз.
Трансляция немесе ақуыз биосинтезі полипептидтің N ұшынан басталып С ұшына қарай жүреді.
Ақуыз биосинтезіне рибосоманың екі бөлшегі, а-РНҚ, т-РНҚ, 20 аминқышқылдар, аминоацил-тРНҚ-синтетаза ферменттері және басқада қосымша ақуыз факторлары қатынасады және олар түрліше қызметтер атқарады.
а-РНҚ ақуыз биосинтезі үшін матрица (қалып) болып табылады, р-РНҚ лар (5S рРНҚ, 5,8 S рРНҚ, 18 S рРНҚ, 28 S рРНҚ) рибосома бөлшектерінің құрамына кіреді, ал рибосомалар болса цитоплазмада ақуыз биосинтезін жүргізуші органеллалар болып табылады. Рибосомалар гиалоплазмада еркін күйінде (полисомалар) кездесуі мүмкін, оларда ішкі ақуыздар синнтезделінеді және мембраналармен байланысқан күйінде кездесуі мүмкін. Бұл жерде «экспорттық», мембраналық және лизосомалық ақуыз молекулалары синтезделінеді. Трансляция немесе ақуыз биосинтезіне еркін аминқышқылдар (жалпы саны 20) қатынаспайды, т-РНҚ-лармен байланысқан аминоацил-т-РНҚ (аа-тРНҚ-Ала-тРНҚ; Мет-т-РНҚмет т.б.) күйінде қатынасады. Әрбір аминқышқылдарына сәйкес келетін, оларды тасымалдайтын т-РНҚ-лар болады.
Гиалоплазмада кездесетін еркін аминқышқылдар (20) өздеріне сәйкес келетін т-РНҚ-ларға қалай болса солай емін-еркін байланыса алмайды. Ол үшін алғаш аминқышқылдарының активтенуі қажет және бұл үдеріс энергия жұмсауды қажет етеді. Энергия көзі болып АТФ гидролизі саналады.
Аминқышқылдарының акткивтенуі және активтенген аминқышқылдардың өздеріне сәйкес т-РНҚ молекуласының акцепторлық ұшына қондырылуын қадағалайтын, басқаратын ерекше ферменттер-аминоацил-т-РНҚ-синтетаза ферменттері болады. Әрбір 20 аминқышқылдарына сәйкес келетін аминоацил-т-РНҚ-синтетаза ферменттері белгілі, демек олардың да соңы - 20. Аминоацил—т-РНҚ-синтетаза ферменттерінде 2танып білуші орталық болады: бірі-аминқышылдарға,екіншісіт-РНҚ-ға арналған.

18-сурет. Аминцил-т-РНҚ синтетаза ферментінің белсенді орталықтары
(Мушкамбаров, Кузнецовтан, 2003)
т-РНҚ-ның а-РНҚ кодондарымен әрекеттесуі комплиментарлық және антипаралель принциптеріне сәйкес жүреді, яғни а-РНҚкодондарының мағынасы 5'→3'бағытында жазылған болса, т-РНҚ-ның антикодондары 3'->5' бағытында оқылады. Бұл кезде кодонның және антикодонның алғашқы 2 нуклеотидтері бір-бірімен тек комплиментарлы байланысады (А-У және Г-Ц), ал үшінші негіздің байланысуы өзгеше болады және ол төмендегі нұсқа бойынша жүзеге асады: т-РНҚ антикодонының үшінші нуклеотиді
а) Егер т-РНҚ антикодонының үшінші нуклеотиді Ц не А болса,
онда ол тек бір түрлі кодонмен байланысады (Ц-Г; А-У);
б) Ал, егер т-РНҚ антикодонының үшінші нуклеотиді У не Г
болатын болса, ол 2 түрлі кодондармен байланыса алады (У –А,Г; Г-У,Ц)
в) Ал егер антикодонның 3-ші нуклеотиді инозин (И) болатын болса, онда ол 3 түрлі кодонмен жұптаса алады И-У,Ц,А;
Әрбір т-РНҚ-лар аминқышқылдарды бірнеше рет тасымалдай алады. Ақуыз синтезі рибосома бөлшектерінің (кіші бөлшегі, үлкен бөлшегі) өзара қосылып, біртұтас органелла пайда етуінен басталады (инициация). Рибосома бөлшектерінің қосылуы белгілі бір тәртіппен жүреді және ол рибосоманың белсенді (актив) орталықтарының қатынасуымен жүзеге асады. Рибосоманың актив (белсенді) орталықтары оның бөлшектерінің (кіші, үлкен) түйісуші беттерінде орналасқан. Біртұтас рибосома пішіні жүрекке ұқсас болады, оның оң жақ бөлігін — кіші бөлшек, сол жақ бөлігін — үлкен бөлшегі құрайды. Екі бөлшектер арасында үлкенді-кішілі қуыстар болады. Осы қуыстарға а-РНҚ, пептидил-т-РНҚ және кезекті аминоацил—т-РНҚ орналасады
(19 сурет).

19-сурет. Рибосомалардың белсенді орталықтары (Мушкамбаров, Кузнецовтан, 2003)
Сонымен рибосомада 4 белсенді (актив) орталықтар кездеседі:
1) а-РНҚ байланысатын орталық (М-орталық), бұл а-РНҚ-ның5'-трансляцияланбайтын учаскесінің 5-9 нуклеатидіне комплиментарлы 18 S р-РНҚ-ның бір учаскесі болып табылады.
2) Пептидил орталығы (П-орталық). Трансляция басталар алдындаосы орталықпен инициаторлық аминоацил -т-РНҚ, яғни инициаторлық аминоацил т-РНҚимет байланысады. Кейінірек П-орталықта өсіп келе жатқан полипептид тізбегіне енді ғана қосылған пептедил-тРНҚ орналасады.
3) Аминқышқылы орталығы (А-орталық) - бұл орталықпенкезекті аа-т-РНҚ байланысады.
4) Пептедилтрансферазалық орталық (ПТФ-орталық)-полипептидтіңаминқышқылдары арасында пептидтік байланыстарды пайда етуші және полипептидті бір аминқышқылына ұзартатын орталық.
Осы 4 орталық рибосома бөлшектерінде түрліше орналасқан: кіші бөлшекте—түгелдей М-орталық, А-орталықтың негізгі бөлігі және П-орталықтың шамалы бөлігі орналасқан; үлкен бөлшекте -П және А орталықтардың қалған бөліктері, яғни П-орталықтың негізгі бөлімі, А-орталықтың шамалы бөлімі және түгелдей ПТФ орталығы орналасқан.
Дәріс
Тақырыбы: Ақуыз биосинтезі (трансляция)
Жоспар: 1.Трансляция немесе ақуыз биосинтезінің инициациясы,элонгация терминациялануы
2. Трансляция ингибиторлары
Ең алдымен а-РНҚ-ның 5'-трансляцияланбайтын учаскесі рибосоманың кіші бөлшегімен (18 S р-РНҚ,) байланысады. Бұл кезде инициаторлық кодон (АУГ) П-орталық деңгейінде орналасады, әрі қарай инициаторлық кодон мен (АУГ) инициаторлық аа-р-РНҚ (Мет-аа-т РНҚимет) комплиментарлы байланысады. Ал, соңғысы үлкен бөлшектің П-орталығымен әрекеттесіп рибосоманың екі бөлшегінің біртұтас органеллаға жинақталуын қамтамасыз етеді (40 еурет).
Сонымен қатар, трансляция инициациясы үшін ГТФ және 3 инициация факторлары-еІҒ-1, еІҒ-2, еІҒ-3, қажет. Бұлардың ішінде еІҒ-3 рибосоманың еркін кіші белшегіне қосылып, оның үлкен бөлшегімен күні бұрын байланысуын болдырмайды және онымен а-РНҚ-ның байланысуына көмектеседі.
еІҒ-2 факторы инициаторлық аа-т-РНҚ-ның байланысуын қамтамасыз етеді. Бұл кешен ГТФ-пен де байланысқан. Содан кейін Мет-т-РНҚимеІ, өз орнына, П-орталыққа орналасу барысында ГТФ-ГДФ-ға дейін гидролизденеді. Бұл кезде еІҒ-3 және, еІҒ-2 рибосоманы тастап шығып кетеді.
Сонымен, белсенді біртұтас рибосоманың жинақталуы, яғни инициаторлық кешеннің түзелуі, бір макроэнергиялық байланыстың үзілуі арқылы жүреді. (ГТФ →ГДФ). Осы кезде бөлінетін энергия үдерістің қажетті бағытта жүруі үшін термодинамикалық стимул болып табылады.

20-сурет. Ақуыз биосинтезінің жобасы (Айала, Кайгерден 1987)
А-еркін бөлшектер; Б-инициаторлық кешен; В-толық жинақталған рибосома
 еІҒ-1 факторы еІҒ-2-ге кезекті ГТФ пен Мет-т-РНҚямеІ жалғау арқылы оның жаңадан зарядталуына мүмкіндік береді.
еІҒ-1 факторы еІҒ-2-ге кезекті ГТФ пен Мет-т-РНҚямеІ жалғау арқылы оның жаңадан зарядталуына мүмкіндік береді.
Инициациядан кейін трансляцияның негізгі кезеңі — элонгация пептидтік тізбектің ұзаруы) басталады. Ол қайталанып отыратын циклдық сипатқа ие, яғни әрбір кезекті аминқышқылының полипептид тізбегіне қосылуы қайталанып отыратын ұқсас құбылыстардан тұрады.
Элонгация циклдары 3 сатыдан тұрады.
а) аа-т-РНҚбайланысуы. циклдың алғашқы сатысында рибосоманың бос А-орталығы а-РНҚ кодонына комплимен-тарлы антикодоны бар кезекті аа-т-РНҚ-мен байланысады. Жалпы алғанда бұл, иницсиаторлық аа-т-РНҚ-ның П-орталықпен байланысуы сияқты жүреді, яғни ГТФ молекуласы және 2 элонгация факторы (ақуыз) -ЕҒ-1и, ЕҒ-1S пайдаланылады. ЕҒ-1и факторы ГТФ-пен және рибосомаға енген кезекті аа-т РНҚ-мен қосылып кешен пайда етеді. Егер осы аа-т-РНҚ-ның антикодоны А-орталықтағы а-РНҚ-ның кодонына комплиментарлы болмаса, кешен бүл жерде тұрақтамай, диффузия жолымен рибосоманы тастап шығады.
Ал егер, антикодон а-РНҚ кодонымен комплиментарлы болатын болса кешен ыдырап, оның аа-т-РНҚ-сы А-орталықпен байланысады. ГТФ ГДФ-ке дейін гидролизде-неді, ал соңғысы ЕҒ-1и факторымен бірге босанып шығады да, әрі қарай рибосомадан тыс ЕҒ-1 S -пен бірге ГДФ-ның ГТФ-ға айналуына қатынасады және аа-т-РНҚ-ның кезекті молекуласымен байланысады.


21-сурет. Элонгация сатылары (Мушкамбаров, Кузнецовтан 2003)
б) Пептиттік байланыстың түзілуі. Циклдың алғашқы сатысынан кейін рибосоманың П-орталығында пептидил-т-РНҚ, А-орталығында аа-т-РНҚ орналасқан. Олардың акцепторлық ұштары және аминқышқылдар қалдықтары ПТФ-орталықта болады. Соңғысы, яғни ПТФ орталық пептидил-трансферазалық реакцияны қалыптастырады, яңни екі аминқышқылдар арасында пептидтік байланысты қалыптастырады. ПТФ реакциясы нәтижесінде пептидил 1 аминқышқылына ұзарады.
в) Транслокация. Циклдың 3-ші сатысында а-РНҚ жаңадан түзілген пептидил-т-РНҚ-мен бірге бір кодонға солға қарай жылжиды. Осының нәтижесінде П-орталықтағы аминқышқылы рибосомадан шығып кетсе, А-орталықтағы пептидил-т-РНҚ П-орталыққа өтеді, А-орталықта а-РНҚ-ның келесі кодоны болады және кезекті аа-т РНҚ-мен комплиментарлы байланысуға дайын.


Транслокация сатысына ГТФ және транслоказа деп аталатын элонгация факторы (ЕҒ-2) қатынасады.
Осымен элонгацияның бір циклы аяқталып, келесі циклы басталады. Пептидтік тізбектің бір аминқышқылына ұзаруы үшін 2 ГТФ молекуласының энергиясы жұмсалады.
Трансляцияның аяқталуы туралы сигнал рибосоманың А—орталығына 3 «мағынасыз» кодонның кез-келгенінің —УАА, УАГ не УГА орналасуы болып табылады.
Бұл кодонды аа-т-РНК, емес, терминацияның ақуыздық факторлары (еRҒ) таниды. Мұндай факторлардың екеуі белгілі, олардың бірі-УАА, УАГ-кодон-дарын таныса, екіншісі - УАА және УГА кодондарын таниды. еRК факторлары «өздерінің» кодондарын танып пептидил трансферазалық (ПТФ) орталықтың гидролазалық белсенділігін стимулдайды. Осыған сәйкес т-РНҚ мен пептид арасындағы байланыс гидролизденеді (22-сурет).

22-сурет. Трансляцияның терминациялануы (Мушкамбаров, Кузнецовтан, 2003)
УУА-терминациялық кодон; еRҒ-терминация факторы; ГА-гидролазалық белсенділік; И-инициаторлық аминқышқылы (метионин)
Осыдан кейін пептидтік тізбек, т-РНҚ және а-РНҚ диссоциацияланып рибосоманы тастап шығады, ал рибосома екі бөлшекке ыдырайды да жаңа полипептидті синтездеуге дайындалады.
2. Трансляция ингибиторлары
Көптеген антибиотиктер қожайын жасушасындағы трансляция процесеіне айтарлықтай әсер етпей микроағзалар трансляциясының арнайы ингибиторлары болып табылады. Олар рибосоманың кіші не үлкен бөлшектеріндегі қызметтік орталықтарға әсер етеді.
а) Стрептомицин - рибосоманың кіші бөлшегіндегі П-орталыққа әсер етеді. Осылайша ол инициаторлық -т-РНҚ-ның (формил мет-т-РНҚимет) П-орталықпен байланысуын қиындатады, яғни ақуыз биосинтезінің иниңиациясына ингибиторлық әсер етеді.
Ақуыз синтезінің инициациясы басталғанымен стрептомицин пептидил-т-РНҚ-ның рибосоманың кіші бөлшегімен байланысуын әлсіздендіреді, бұл рибосомалық кешеннің әлсіз болуына және күні бұрын ыдырап кетуіне алып келеді (23-сурет).

Не нашли, что искали? Воспользуйтесь поиском: