
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Валентные возможности атомов – весь набор возможных валентностей. Они определяются числом неспаренных электронов и возможных донорно-акцепторных связей (ДАС).
Высшая возможная валентность элементов (без учёта ДАС), как правило, равнa номеру группы. Это правило не выполняется:
А) у элементов второго периода, начиная с азота (у них отсутствуют d- орбитали и нет возможности для распаривания электронов)
Б) у элементов 8 группы (в главной подгруппе для гелия, неона и в побочной подгруппе для элементов триад)
В) у элементов 1 группы побочной подгруппы (у них высшая валентность больше номера группы).
Пример: у серы на третьем внешнем слое есть 6 электронов.
В невозбуждённом (основном) состоянии она имеет валентность II:
S…3s23p4
| ↑↓ | ↑↓ | ↑ | ↑ |
При переходе одного электрона на d – оболочку она становится четырёхвалентной:
S*…3s23p33d1
| ↑↓ | ↑ | ↑ | ↑ | ↑ |
Максимально возможная валентность – VI:
S** …3s13p33d2
| ↑ | ↑ | ↑ | ↑ | ↑ |
Степень окисления – гипотетический заряд у атома в молекуле, рассчитанный, исходя из предположения об ионном характере всех связей и из того, что в целом молекула электронейтральна.
Пример: +1 +6 -2
K2 Cr2 O7 (+1) ∙2 + (+6) ∙2 + (-2) ∙7 = 0
 Строение вещества определяется не только взаимным расположением атомов в химических частицах, но и расположением этих химических частиц в пространстве. Наиболее упорядочено размещение атомов, молекул и ионов в кристаллах (от греческого "кристаллос" - лед), где химические частицы (атомы, молекулы, ионы) расположены в определенном порядке, образуя в пространстве кристаллическую решетку.
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллических решеток:
· Атомная
· Молекулярная
· Металлическая
· Ионная
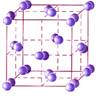
Ионные кристаллические решетки образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь.
Ионные кристаллы могут состоять из одноатомных ионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция.
Строение вещества определяется не только взаимным расположением атомов в химических частицах, но и расположением этих химических частиц в пространстве. Наиболее упорядочено размещение атомов, молекул и ионов в кристаллах (от греческого "кристаллос" - лед), где химические частицы (атомы, молекулы, ионы) расположены в определенном порядке, образуя в пространстве кристаллическую решетку.
В зависимости от того, из каких частицы построена кристаллическая решетка и каков характер химической связи между ними, выделяют различные типы кристаллических решеток:
· Атомная
· Молекулярная
· Металлическая
· Ионная
Ионные кристаллические решетки образованы катионами и анионами (например, соли и гидроксиды большинства металлов). В них между частицами имеется ионная связь.
Ионные кристаллы могут состоять из одноатомных ионов. Так построены кристаллы хлорида натрия, иодида калия, фторида кальция.
 В образовании ионных кристаллов многих солей участвуют одноатомные катионы металлов и многоатомные анионы, например, нитрат-ион NO3−, сульфат-ион SO42−, карбонат-ион CO32−.
Обычно ионные кристаллы твердые, но хрупкие. Их хрупкость обусловлена тем, что даже при небольшой деформации кристалла катионы и анионы смещаются таким образом, что силы отталкивания между одноименными ионами начинают преобладать над силами притяжения между катионами и анионами, и кристалл разрушается.
Ионные кристаллы отличаются высокими температурами плавления. В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны. При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Атомные кристаллические решетки состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния, карбид кремния) также образуют атомные кристаллы.
Атомные кристаллы очень прочные и твердые, плохо проводят теплоту и электричество. Вещества, имеющие атомные кристаллические решетки, плавятся при высоких температурах. Они практически нерастворимы в каких-либо растворителях. Для них характерна низкая реакционная способность.
В образовании ионных кристаллов многих солей участвуют одноатомные катионы металлов и многоатомные анионы, например, нитрат-ион NO3−, сульфат-ион SO42−, карбонат-ион CO32−.
Обычно ионные кристаллы твердые, но хрупкие. Их хрупкость обусловлена тем, что даже при небольшой деформации кристалла катионы и анионы смещаются таким образом, что силы отталкивания между одноименными ионами начинают преобладать над силами притяжения между катионами и анионами, и кристалл разрушается.
Ионные кристаллы отличаются высокими температурами плавления. В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны. При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Атомные кристаллические решетки состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы имеют такие кристаллические решетки. Нередко соединения неметаллов друг с другом (например, диоксид кремния, карбид кремния) также образуют атомные кристаллы.
Атомные кристаллы очень прочные и твердые, плохо проводят теплоту и электричество. Вещества, имеющие атомные кристаллические решетки, плавятся при высоких температурах. Они практически нерастворимы в каких-либо растворителях. Для них характерна низкая реакционная способность.
 Кристалл графита
Молекулярные кристаллические решетки построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть. Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток.
Большинство неметаллов в виде простых веществ (например, иод I2, аргон Ar, сера S8) и соединений друг с другом (например, вода, диоксид углерода, хлороводород), а также практически все твердые органические вещества образуют молекулярные кристаллы.
Кристалл графита
Молекулярные кристаллические решетки построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Они легко разрушаются, поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть. Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток.
Большинство неметаллов в виде простых веществ (например, иод I2, аргон Ar, сера S8) и соединений друг с другом (например, вода, диоксид углерода, хлороводород), а также практически все твердые органические вещества образуют молекулярные кристаллы.
 Молекула иода.
Для простых веществ- металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл. Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью.
Классификация кристаллических решеток отвечает предельным случаям. Большинство кристаллов неорганических веществ принадлежит к промежуточным типам - ковалентно-ионным, молекулярно-ковалентным и т.д. Например, в кристалле графита внутри каждого слоя связи ковалентно-металлические, а между слоями - межмолекулярные.
Молекула иода.
Для простых веществ- металлов характерна металлическая кристаллическая решетка. В ней имеется металлическая связь между атомами. В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной. Связь в таких кристаллах является делокализованной и распространяется на весь кристалл. Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью.
Классификация кристаллических решеток отвечает предельным случаям. Большинство кристаллов неорганических веществ принадлежит к промежуточным типам - ковалентно-ионным, молекулярно-ковалентным и т.д. Например, в кристалле графита внутри каждого слоя связи ковалентно-металлические, а между слоями - межмолекулярные.