
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Фізико-хімічні властивості протеїногенних амінокислот
2.3.1. Кислотно-основні властивості. Амінокислоти мають радикал і дві функціональні групи із протилежними властивостями: кислу – карбоксильну та основну – аміногрупу. Амінокислоти є амфотерними електролітами, що можуть дисоціювати з утворенням іонних форм – аніона або катіона. У водному середовищі амінокислоти існують у вигляді рівноважної суміші, що складається з аніонної, катіонної форм та біполярного іона (цвітер-іона).
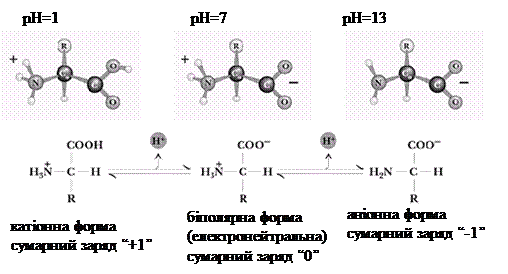
Зазначені реакції утворення аніонів, катіонів та біполярних іонів амінокислот повністю відповідають тільки схемі кислотно-основної дисоціації моноаміномонокарбонових амінокислот. У цьому найпростішому випадку рівновага між позитивно та негативно зарядженими молекулами може теоретично досягатися вже в нейтральних розчинах, тобто при рН=7.
Таким чином, нейтральні амінокислоти у воді мають сумарний нульовий заряд і можуть функціонувати або як кислоти (донори протонів), або як основи (акцептори протонів). Речовини з такими подвійними властивостями є амфотерними (із грецької “amphi” – обидва) і часто їх називають амфолітами, (скорочення від слів амфотерні електроліти).
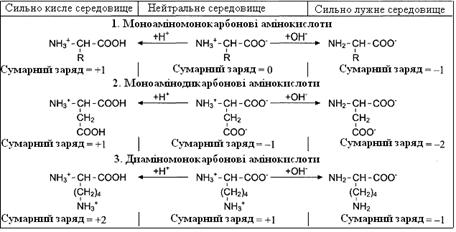
Кислі (моноамінодикарбонові) амінокислоти мають дві карбоксильні групи, які дисоціюють, віддаючи 2 протони, але оскільки в них тільки одна аміногрупа, що приймає один протон, то такі амінокислоти поводять себе як кислоти та їх розчин має кислу реакцію. Сам іон амінокислоти заряджається негативно (сумарний заряд “-1”).
Основні (диаміномонокарбонові) амінокислоти реагують у водному розчині як слабкі основи, оскільки один протон, який вивільняється при дисоціації карбоксильної групи таких амінокислот, зв’язується з однією з аміногруп, а друга аміногрупа зв’язує протон із водного оточення, у результаті збільшується кількість OH– груп і підвищується pH. Заряд іона таких амінокислот буде позитивним (сумарний заряд “+1”).
При додаванні до розчину амінокислот додаткової кількості протонів (кислоти) пригнічується дисоціація карбоксильних груп та збільшується кількість позитивно заряджених NH3+-груп. Отже, у сильно кислому середовищі всі амінокислоти переходять у катіонну форму (набувають позитивного заряду). При додаванні лугу, навпаки, збільшується дисоціація карбоксильних груп. Отже, у сильно лужному середовищі всі амінокислоти переходять у аніонну форму (набувають негативного заряду). Таким чином, змінюючи pH розчину, можна змінювати заряд молекул амінокислот.
Таблиця 1 – Зміна сумарного заряду амінокислот залежно від рН середовища
(за Є. С. Северіним та ін.)
 |
При певному значенні pH середовища настає такий стан, при якому заряд амінокислоти дорівнює нулю. Таке значення pH називається ізоелектричною точкою (ІЕТ) і позначається рI. При значенні pH, що дорівнює ізоелектричній точці, амінокислота не переміщується в електричному полі. Якщо pH нижче ІЕТ, то катіон амінокислоти рухається до негативно зарядженого катода, а при pH вище ІЕТ аніон амінокислоти – до позитивно зарядженого анода. На цих властивостях амінокислот базується можливість їх розділення в електричному полі (електрофорез). Для нейтральних α-амінокислот значення ІЕТ є дещо нижчими ніж 7 (5,5-6,3) унаслідок більшої здатності до іонізації карбоксильної групи. У кислих α-амінокислот (аспарагінова і глутамінова кислоти) ІЕТ знаходиться значно нижче 7, наприклад, для аспарагінової кислоти рІ=2,97 і при фізіологічних значеннях рН (наприклад, крові 7,36–7,44) вони знаходяться у вигляді аніонів, оскільки у них іонізовані обидві карбоксильні групи. Для лужних амінокислот ІЕТ знаходиться у межах рН вище 7, і в організмі вони містяться у вигляді катіонів, тобто в них протонізовані обидві аміногрупи. Крім того, при рН=рІ амінокислоти мають найнижчу розчинність у воді.
На рисунку 1 подано криву титрування на прикладі амінокислоти гліцину. Титрування відбувається через дві стадії, кожна з яких відповідає відщепленню одного протона. На самому початку титрування гліцину його молекули знаходяться у повністю протонованій формі, і в розчині переважають іони +NH3–CH2–COOH. У середній точці ділянки кривої, що відповідає першій стадії титрування, коли відбувається відщеплення протона від карбоксильної групи, наявні еквімолярні концентрації донора (+NH3–CH2–COOH) та акцептора (+NH3–CH2–COO–) протонів. У даному випадку середній точці кривої на першій стадії титрування відповідає рН 2,34, отже, величина константи дисоціації α-СООН-групи гліцину (pK1’) дорівнює 2,34. Продовжуючи титрування, ми досягнемо другої важливої точки, що відповідає рН 5,97, – точки перегину кривої. Саме в цей момент закінчується стадія відщеплення першого протона і починається стадія відщеплення другого протона. При цьому значенні рН гліцин знаходиться переважно у формі біполярного іона +NH3–CH2–COO–, і його заряд дорівнює нулю. Таким чином, рН 5,97 є ізоелектричною точкою для гліцину.
На другій стадії титрування відбувається відщеплення протона від +NH3-групи гліцину. Середня точка цієї ділянки кривої титрування відповідає еквімолярним концентраціям іонів +NH3–CH2–COO– і NH2–CH2–COO–. Значення рН у цій точці дорівнює 9,60, таке саме значення має і константа дисоціації α-+NH3-групи гліцину (pK2’). Титрування завершується приблизно при рН 12, коли гліцин знаходиться переважно у формі повністю депротонованих іонів NH2–CH2–COO–.
Значення ІЕТ для амінокислот, що містять одну α-аміногрупу, одну α-карбоксильну групу і бічний радикал, що не дисоціює, може бути обчислене, використовуючи таку формулу:
pI = ½(pK1’+ pK2’),
де pK1’ – константа дисоціації α-СООН-групи амінокислоти;
pK2’ – константа дисоціації α-+NH3-групи амінокислоти.
Для гліцину pI = ½(2,34+ 9,60)=5,97.
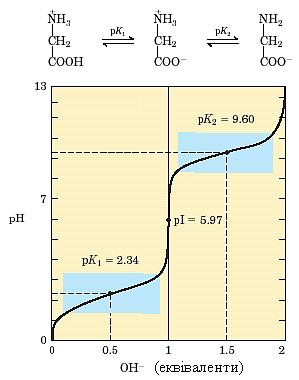 |
Рисунок 1 – Крива титрування 0,1 М гліцину
Амінокислоти, які мають дві карбоксильні групи (моноамінодикарбонові кислоти), титруються в 3 етапи:
1) дисоціація α-СООН-групи амінокислоти;
2) дисоціація СООН-групи бічного радикала;
3) дисоціація α-+NH3-групи амінокислоти.
Значення ІЕТ для амінокислот, що містять дві карбоксильні групи та одну α-аміногрупу, може бути обчислене, використовуючи таку формулу:
pI = ½(pK1’+ pK2’),
де pK1’ – константа дисоціації α-СООН-групи амінокислоти;
pK2’ – константа дисоціації СООН-групи бічного радикала.
Для глутамінової кислоти pI = ½(2,19+ 4,25)=3,22.
Амінокислоти, які мають дві аміногрупи (диаміномонокарбонові кислоти), титруються в 3 етапи:
1) дисоціація α-СООН-групи амінокислоти;
2) дисоціація α-+NH3-групи амінокислоти;
3) дисоціація +NH3-групи бічного радикала.
Значення ІЕТ для амінокислот, що містять дві аміногрупи та одну α-карбоксильну групу, може бути обчислене, використовуючи таку формулу:
pI = ½(pK1’+ pK2’),
де pK1’ – константа дисоціації α-+NH3-групи амінокислоти;
pK2’ – константа дисоціації +NH3-групи бічного радикала.
Для аргініну pI = ½(9,04+ 12,48)=10,76.
У цистеїні та тирозині R-група бічного радикала іонізується раніше, ніж α-+NH3-група, тому значення ІЕТ для цих амінокислот може бути обчислене, використовуючи таку формулу:
pI = ½(pK1’+ pK2’),
де pK1’ – константа дисоціації α-СООН-групи амінокислоти;
pK2’ – константа дисоціації R-групи бічного радикала.
Для цистеїну pI = ½(1,71+ 8,33)=5,02.
Для тирозину pI = ½(2,20+ 9,11)=5,65.
У таблиці А. 1 наведені значення pK дисоціації α-СООН-, α-+NH3- та R-груп протеїногенних амінокислот.
2.3.2. Стереоізомерія. Усі α-амінокислоти, крім гліцину, оптично активні і можуть існувати у вигляді L- або D-стереоізомерів. Стереоізомерія зумовлена наявністю в амінокислоті асиметричного α-вуглецевого атома (називається хіральний центр), біля якого розташовані чотири різні функціональні групи.
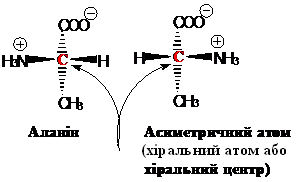 |
До складу білків організму людини і тварин входять тільки амінокислоти, що мають L-конфігурацію. У їх проекціях аміногрупа знаходиться ліворуч подібно до гідроксигрупи в L-гліцериновому альдегіді.
 |
Використання α-амінокислот L-ряду для біосинтезу білків людського організму має надзвичайно важливе значення у формуванні їх просторової структури та виявленні біологічної активності. Із цим безпосередньо пов’язана стереоспецифічність дії ферментів-білків. Залишки D-α-амінокислот входять до складу багатьох природних пептидів, насамперед антибіотиків. D-амінокислоти знайдено у складі біополімерів клітинних стінок бактерій. Наприклад, залишок D-глутамінової кислоти входить до оболонки бактерій сибірської виразки.
|
2.3.3. Спектральні властивості. Усі амінокислоти поглинають світло в інфрачервоній області спектру. В ультрафіолетовій області поглинають світло три циклічних амінокислоти: тирозин, триптофан (λmax=280 нм) і фенілаланін (λmax=260 нм). Цю властивість широко використовують для аналітичного визначення білків.
2.3.4. Полярність. Залежно від полярності бічних радикалів (R-груп) амінокислоти в більшій або меншій мірі взаємодіють із диполями води, тобто проявляють гідрофільні або гідрофобні властивості.
Не нашли, что искали? Воспользуйтесь поиском: