
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Картина электрофореза белков сыворотки крови
Так как глобулины включают в себя разнообразные белки, то их функции разнообразны:
Часть α-глобулинов обладает антипротеазной активностью, что защищает белки крови от преждевременного разрушения, например, α1-антитрипсин, α1-антихимотрипсин, α2-макроглобулин.
Некоторые глобулины способны к связыванию определенных веществ: трансферрин (переносит ионы железа), церулоплазмин (содержит ионы меди), гаптоглобин (переносчик гемоглобина),гемопексин (транспорт гема).
γ-Глобулины являются антителами и обеспечивают иммунную защиту организма.
Гистоны
 Взаимодействие гистонов и ДНК
Взаимодействие гистонов и ДНК
| |
 Участок суперспирали ДНК
Участок суперспирали ДНК
|
Гистоны – внутриядерные белки массой около 24 кДа. Обладают выраженными основными свойствами, поэтому при физиологических значениях рН заряжены положительно и связываются сдезоксирибонуклеиновой кислотой(ДНК), образуя дезоксирибо-нуклеопротеины. Существуют 5 типов гистонов – очень богатый лизином (29%) гистон Н1, другие гистоны Н2а, H2b, НЗ, Н4 богаты лизином и аргинином (в сумме до 25%).
Радикалы аминокислот в составе гистонов могут быть метилированы, ацетилированы или фосфорилированы. Это изменяет суммарный заряд и другие свойства белков.
Можно выделить две функции гистонов:
1. Регуляция активности генома, а именно – они препятствуют транскрипции.
2. Структурная – стабилизируют пространственную структуру ДНК.
Гистоны в комплексе с ДНК образуют нуклеосомы – октаэдрические структуры, составленные из гистонов Н2а, H2b, НЗ, Н4. Между нуклеосомами располагается гистон H1, также связанный с молекулой ДНК. ДНК обвивает нуклеосому 2,5 раза и переходит к гистону H1, после чего обвивает следующую нуклеосому. Благодаря такой укладке достигается уменьшение размеров ДНК в 7 раз.
Далее такие "бусы" нуклеосом могут складываться в суперспираль и более сложные структуры.
Протамины
Это белки массой от 4 кДа до 12 кДа, у ряда организмов (рыбы) они являются заменителями гистонов, есть в спермиях. Отличаются резко увеличенным содержанием аргинина (до 80%). Протамины присутствуют в клетках, не способных к делению. Их функция как у гистонов – структурная.
Коллаген

|
| Синтез коллагена |
Фибриллярный белок с уникальной структурой. Составляет основу межклеточного вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конечно, и в других тканях.
Обычно содержит моносахаридные (галактоза) и дисахаридные (галактоза-глюкоза) остатки, соединенные с ОН-группами некоторых остатков гидроксилизина.
Полипептидная цепь коллагена включает 1000 аминокислот и состоит из повторяющегося триплета [ Гли-А-В ], где А и В – любые, кроме глицина, аминокислоты. В основном это аланин, его доля составляет 11%, доля пролина и гидроксипролина – 21%. Таким образом, на другие аминокислоты приходится всего 33%. Структура пролина и гидроксипролина не позволяет образовать α-спиральную структуру, из-за этого образуется левозакрученная спираль, где на один виток приходится 3 аминокислотных остатка.
При синтезе коллагена первостепенное значение имеет гидроксилирование лизина и пролина, включенных в состав первичной цепи, осуществляемое при участии аскорбиновой кислоты.
Синтезированная молекула коллагена построена из 3 полипептидных цепей, сплетенных между собой в плотный жгут – тропоколлаген (длина 300 нм, диаметр 1,6 нм). Полипептидные цепи прочно связаны между собой через ε-аминогруппы остатков лизина. Тропоколлаген формирует крупные коллагеновые фибриллы диаметром 10-300 нм. Поперечная исчерченность фибриллы обусловлена смещением молекул тропоколлагена друг относительно друга на 1/4 их длины.
В коже фибриллы образуют нерегулярно сплетенную и очень густую сеть. Например, выделанная кожа представляет собой почти чистый коллаген.
Эластин
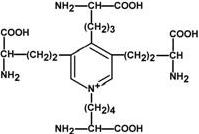 Строение десмозина
Строение десмозина
|
По строению в общих чертах эластин схож с коллагеном. Находится в связках, эластичном слое сосудов. Структурной единицей является тропоэластин с молекулярной массой 72 кДа и длиной 800 аминокислотных остатков. В нем гораздо больше лизина, валина, аланина и меньше гидроксипролина. Отсутствие пролина обуславливает наличие спиральных эластичных участков.
Характерной особенностью эластина является наличие своеобразной структуры – десмозина, который своими 4-мя группами объединяет белковые цепи в системы, способные растягиваться во всех направлениях.
α-Аминогруппы и α-карбоксильные группы десмозина включаются в образование пептидных связей одного или нескольких белков.

Не нашли, что искали? Воспользуйтесь поиском: