
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Удобрения и их классификация
Растения в основном состоят из кислорода, углерода и водорода. Но если провести полный химический анализ, то во взрослом растении можно будет обнаружить около 70 элементов таблицы Менделеева, большинство из которых необходимы растению в процессе его развития и роста.
Некоторые из них — макроэлементы — необходимы растениям в больших количествах; другие же — микроэлементы — требуются в незначительных количествах:
1. Макроэлементы — углерод, кислород, водород, азот, фосфор, сера, магний, калий, кальций. Три важнейших макроэлемента — азот (N), фосфор (Р) и калий (К).
2. Микроэлементы — железо, марганец, бор, медь, цинк, молибден, кобальт и др. При наличии микроэлемента бора растения лучше усваивают азот, фосфор и калий. Медь, марганец и цинк ускоряют окислительно-восстановительные процессы и тем самым способствуют росту растений. Железо участвует в синтезе хлорофилла.
Все необходимые химические элементы растения получают из почвы. Однако в природе взятые из почвы вещества постепенно возвращаются обратно и никуда не улетучиваются (закон возврата – важнейший закон земледелия). На землях, обрабатываемых человеком, часть минеральных веществ выносится с урожаем. Кроме того, из-за рыхления земли полезные вещества "выветриваются". Круговорот элементов нарушается, и ежегодное внесение удобрений становится необходимым для возмещения "убытков" нашей почве.
По происхождению удобрения разделяют на: органические, органоминеральные, неорганические (минеральные), бактериальные.
Органические удобрения - питательные элементы в них находятся в органических веществах растительного и животного происхождения. При разложении органических удобрений в результате жизнедеятельности почвенных микроорганизмов образуются доступные растениям минеральные соединения N, Р, К, Са, S и др. Выделяющийся при этом углекислый газ насыщает почвенный воздух и приземной слой атмосферы, улучшая углеродное питание растений. К ним относятся навоз, торф, компост, птичий помет, зеленое удобрение (растения сидераты - люпин, клевер, вика – запахивают в почву), отходы городского коммунального хозяйства (мусор и компосты из него, осадки сточных вод, фекальные массы), а также сапропель (ил), солома, гуано (помет морских птиц) и др. Органические удобрения известны с раннего периода истории земледелия. В Азии (Китай, Япония) их начали применять 3 тыс. лет назад.
Органоминеральные удобрения содержат органические и минеральные вещества. Их получают путем обработки аммиаком и фосфорной кислотой органических веществ (торфа, сланцев, бурого угля) или путем смешивания навоза либо торфа с фосфорными удобрениями.
Минеральные удобрения — неорганические вещества (в основном соли), содержащие необходимые для растений элементы питания. В 1761 году шведский ученый Валериус высказал гипотезу о том, что растения питаются гумусом. Этот ошибочный взгляда под названием "гумусовая теория" был достаточно распространен. Однако гумус появляется в почве только в результате гниения растений, т.е. является образованием вторичным. И только с 1859 года, когда ученые Кноп и Сакс вᴨервые доказали возможность выращивания растений на растворах минеральных солей, теория минерального питания растений стала безраздельно господствующей. Именно она дала толчок к развитию производства минеральных удобрений.
Минеральные удобрения получают химической или механической обработкой неорганического сырья. По агрохимическому воздействию минеральные удобрения могут быть прямые и косвенные. Прямые удобрения предназначаются для непосредственного питания растений и делятся на простые ( содержат один из элементов питания - азотные, фосфорные, калийные, микроудобрения: борные, медные, марганцевые и т. д.) и комплексные (содержат не менее двух питательных элементов). Комплексные удобрения делят на смешанные и сложные. Смешанные удобрения - это смеси простых удобрений. Сложные удобрения содержат два или три питательных элемента в составе одного химического соединения. Например, аммофос - NH4H2PO4, калийная селитра - KNО3, магний – аммоний фосфат MgNH4PO4.
До революции производства минеральных удобрений в России практически не было; вся продукция нескольких мелких заводов составляла в 1913 г. только 89 тыс. т. Строительство новых заводов началось лишь в 1925-1926 гг. и приобрело в дальнейшем большой размах.
Особенно выросло производство минеральных удобрений после окончания второй мировой войны. Если в 1940 г. было произведено всех минеральных удобрений только 3,2 млн. т, то в 1954 г. выработка удобрений составила почти 8 млн. т, а через 10 лет - уже 25,6 млн. т.
Косвенные удобрения применяют для химического, физического, микробиологического воздействия на почву с целью улучшения условий использования удобрений. Например, для нейтрализации кислотности почв применяют молотые известняки, доломит, гашеную известь; для мелиорации солонцов используют гипс; для подкисления почв используют гидросульфит натрия.
Бактериальные удобрения — препараты, которые не содержат самих питательных элементов, а лишь полезные для сельскохозяйственных растений почвенные микроорганизмы. При внесении этих удобрений усиливаются биохимические процессы, фиксирующие органическое вещество почвы и удобрений (азотобактерин, нитрагин почвенный).
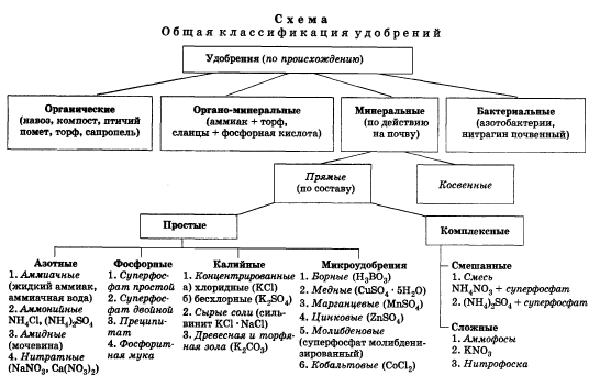
Рис. 1.1.1 Общая классификация удобрений
Азотные удобрения
Азоту принадлежит ведущая роль в повышении урожая сельскохозяйственных культур. Д. Н. Прянишников подчеркивал, что главным условием, определяющим урожай, является степень обеспеченности сельскохозяйственных растений азотом. Азот входит в состав белков, являющихся главной составной частью цитоплазмы и ядра клеток, в состав нуклеиновых кислот, хлорофилла, ферментов, фосфатидов, большинства витаминов и других органических азотистых соединений, которые играют важную роль в процессах обмена веществ в растении.
Поступившие в растения минеральные формы азота проходят сложный цикл превращений, в конечном итоге включаясь в состав органических азотистых соединений — аминокислот, амидов и, наконец, белка. Синтез органических азотистых соединений происходит через аммиак, образованием его завершается и их распад. Аммиак, по выражению Д. Н. Прянишникова, «...есть альфа и омега в обмене азотистых веществ у растений». Нитратный азот не может непосредственно использоваться растениями для синтеза аминокислот. Нитраты в растениях подвергаются ступенчатому ферментативному восстановлению через нитрит, гипонитрит и гидроксиламин восстановлению до аммиака:
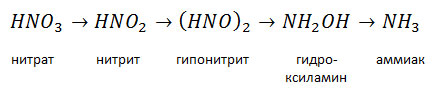
Восстановление нитратов в растениях осуществляется по мере использования образующегося аммиака на синтез органических азотистых соединений. Нитраты безвредны для растений и могут накапливаться в их тканях в значительных количествах. Однако содержание нитратов в сельскохозяйственной продукции (кормах и овощах) выше определенного предела может оказывать токсическое действие на организм животных и человека.
Наряду с синтезом в растениях происходит распад белков на аминокислоты с отщеплением аммиака под действием протеолитических ферментов. В молодых растущих органах и растениях синтез белков превышает распад, по мере старения процессы расщепления активизируются и начинают преобладать над синтезом.
При достаточном снабжении растений азотом в них усиливается синтез органических азотистых веществ. Растения образуют мощные листья и стебли с интенсивно-зеленой окраской, хорошо растут и кустятся; улучшается формирование и развитие органов плодоношения. В результате резко повышаются урожай и содержание белка в нем. Однако при одностороннем избытке азота задерживается созревание растений, они образуют большую вегетативную массу, но мало зерна или клубней и корнеплодов; у зерновых и льна избыток азота может вызывать полегание.
При недостатке азота рост растений резко замедляется, листья бывают мелкие, бледно-зеленой окраски, что связано с нарушением синтеза хлорофилла, преждевременно желтеют, стебли становятся тонкими и слабо ветвятся. Ухудшаются также формирование и развитие репродуктивных органов и налив зерна, сильно снижаются урожай и содержание белка в нем.
По химическому составу азотные удобрения подразделяются на четыре группы:
- аммиачные удобрения – содержат азот в аммиачной форме: жидкий (безводный) аммиак NH3, аммиачная вода (раствор аммиака в воде). Жидкий аммиак - самое концентрированное безбаластное удобрение с содержанием азота 82,3%. Получается сжижением газообразного аммиака под давлением. При хранении в открытых сосудах быстро испаряется. Поэтому его хранят и перевозят в специальных толстостенных стальных цистернах, рассчитанных на давление 25-30 атм. Вследствие большой упругости паров емкости для хранения и транспортировки жидкого аммиака заполняются не полностью. Жидкий аммиак корродирует медь, цинк и их сплавы, но практически нейтрален по отношению к железу, чугуну, стали. Аммиачная вода (водный аммиак) —первый сорт этого удобрения содержит 20,5% азота (25%-й аммиак), второй -16,4% азота (20%-й аммиак). Аммиачная вода имеет невысокое давление, не разрушает черные металлы. Поэтому для работы с ней используют резервуары из обычной углеродистой стали. Азот в аммиачной воде содержится в форме аммиака (NH3) и аммония (NH4OH): NH3 + H2O=NH4OH (или NH3·H2O). Причем свободного аммиака содержится значительно больше, чем аммония, что обусловливает возможные потери азота за счет улетучивания. Работать с аммиачной водой проще, чем с безводным аммиаком, но она малотранспортабельна в связи с низким содержанием азота, поэтому аммиачную воду экономичнее применять в хозяйствах, расположенных вблизи предприятий, производящих это удобрение.
- аммонийные удобрения – содержат азот в аммонийной форме: сульфат аммония (NH4)2SO4, хлорид аммония (нашатырь) NH4Cl, сульфат аммония-натрия NаNH4SO4. Сульфат аммония содержит 20,5% азота и представляет собой кристаллический продукт белого или серого цвета, хорошо растворимый в воде. Физиологически кислое удобрение, поэтому целесообразно его применение на почвах, насыщенных основаниями. Также важной составляющей этого удобрения является сера, которая в входит в состав белков и таких незаменимых аминокислот как метионин и цистин. Получают взаимодействием серной кислоты с аммиаком: Н2SО4+2NH3=(NH4)2SO4. Хлорид аммония содержит до 25% азота, представляет собой белый кристаллический порошок, хорошо растворяется в воде. Физиологически кислое удобрение, используется для нейтральных и щелочных почв под культуры, слабо реагирующие на избыток хлора (сахарная свекла, рис, кукуруза). Пищевая добавка хлорид аммония Е510 является эмульгатором, загустителем и улучшителем свойств муки. В промышленности хлорид аммония получают упариванием маточного раствора, остающегося после отделения гидрокарбоната натрия NaHCO3 после реакции, в которой углекислый газ пропускают через раствор аммиака и хлорида натрия: NH3+H2O+CO2+NaCl = NaHCO3+NH4Cl.
- амидные удобрения – содержат азот в амидной форме: мочевина, или карбамид CO(NH2)2. Мочевина содержит 46% азота. Это самое концентрированное из твердых азотных удобрений. Азот в мочевине находится в органической форме в виде амида карбаминовой кислоты СO(NH2)OH. Имеет вид гранул, хорошо растворима в воде. Мочевина - конечный продукт обмена белков у большинства животных организмов, включая человека. В почве она растворяется и под действием фермента уреазы превращается в диоксид углерода и аммиак: CO(NH2)2+H2O→CO2+2NH3. Мочевина в промышленности получается в результате взаимодействия углекислого газа и аммиака при высоком давлении и темᴨературе: CO2+2NH3= СО(NH2)2+H2O.
- нитратные удобрения - содержат азот в нитратной форме: натриевая (чилийская) селитра NaNO3, кальциевая селитра Ca(NO3)2. Натриевая селитра представляет собой бесцветные прозрачные кристаллы с резким горько-соленым вкусом. Хорошо растворима в воде. Вᴨервые это вещество было использовано как удобрение в 1825 г в Гамбурге. Натриевую селитру также применяют в пищевой промышленности (консервант Е251), в металлургии, в стекольной промышленности. Добывается из природных залежей в Чили, поэтому еще известна под названием чилийской селитры. В промышленности получают путем адсорбции оксилов азота раствором щелочи с последующим окислением образовавшихся нитритов натрия азотной кислотой:
2NaOH + NO + NО2 = 2NaNО2 + H2О
2NaOH + 2NО2 = NaNО3 + NaNО2 + H2О
3NaNО2 + 2HNО3 = 3NaNО3 + 2NO + Н2О
Другой способ получения основан на обменной реакции между нитратами кальция или аммония с хлоридом, сульфатом или карбонатом натрия:
2CaNO3+2NaCl=2NaNO3+CaCl2
Ca(NО3)2 + Na2SО4 = 2NaNО3 + CaSО4
2NH4NО3+Na2CО3 = 2NaNО3 + (NH4)2CО3
- аммонийно-нитратные удобрения – содержат азот в аммонийной и нитратной форме: аммиачная селитра NH4NО3 . Аммиачная селитра содержит 34-35% азота и является наиболее распространенной формой азотных удобрений. Соль бесцветна, гигроскопична, имеет вид гранул. Физиологически кислое удобрение. Получают при нейтрализации азотной кислоты аммиаком: NH3+HNO3=NH4NO3.
Калийные удобрения
Калий является одним из основных наряду с азотом и фосфором необходимых элементов минерального питания. В отличие от азота и фосфора он не входит в состав органических соединений в растении, а находится в клетках растения в ионной форме в виде растворимых солей в клеточном соке и частично в виде непрочных адсорбционных комплексов с коллоидами цитоплазмы. Калия значительно больше в молодых жизнедеятельных частях и органах растения, чем в старых.
Большой вклад в изучение роли калийных удобрений в питании растений сделал выдающийся ученый-агрохимик Ф.В. Турчин. Им внесено новое представление о значении калия в азотном и углеводном обмене, в синтезе азотных органических соединениях, установлена сᴨецифическая роль калия в нитратном и аммиачном питании растений. Ф.В. Турчин доказал, что недостаток калия вызывает обильное накопление NH4+, приводящее к аммиачному отравлению.
Физиологические функции калия в растительном организме разнообразны. Он оказывает положительное влияние на физическое состояние коллоидов цитоплазмы, повышает их оводненность, набухаемость и вязкость, что имеет большое значение для нормального обмена веществ в клетках, а также для повышения устойчивости растений к засухе. При недостатке калия и усилении транспирации (испарения) растения быстрее теряют тургор и вянут.
Калий положительно влияет на интенсивность фотосинтеза, окислительных процессов и образование органических кислот в растении, он участвует в углеводном и азотном обмене. При недостатке калия в растении тормозится синтез белка, в результате нарушается весь азотный обмен. Недостаток калия особенно сильно проявляется при питании растений аммонийным азотом. Внесение высоких норм аммонийного азота при недостатке калия приводит к накоплению в растениях большого количества непереработанного аммиака, оказывающего вредное действие на растение. При внесении калийных удобрений аммонийный азот быстрее используется для синтеза аминокислот и вредное действие его избытка устраняется. При недостатке калия задерживается превращение простых углеводов (моноз) в более сложные (олиго- и полисахариды).
Калий повышает активность ферментов, участвующих в углеводном обмене, в частности сахаразы и амилазы. Этим объясняется положительное влияние калийных удобрений на накопление крахмала в клубнях картофеля, сахара в сахарной свекле и других корнеплодах. Под влиянием калия повышается морозоустойчивость растений, что связано с большим содержанием сахаров и увеличением осмотического давления в клетках.
При достаточном калийном питании повышается устойчивость растений к различным заболеваниям, например у зерновых хлебов — к мучнистой росе и ржавчине, у овощных культур, картофеля и корнеплодов — к возбудителям гнилей. Калий способствует развитию механических элементов, сосудистых пучков и лубяных волокон, поэтому положительно влияет на прочность стеблей и устойчивость растений к полеганию, на выход и качество волокна льна и конопли.
При недостатке калия угнетается развитие репродуктивных органов — задерживается развитие бутонов и зачаточных соцветий, зерно получается щуплым, с пониженной всхожестью.
Явные внешние признаки калийного голодания проявляются у растений при снижении содержания в них калия в 3—5 раз по сравнению с нормальным. Края и кончики листьев, прежде всего нижних, буреют, приобретают обожженный вид (так называемый краевой ожог), на пластинке появляются мелкие ржавые пятна. Калия обычно всегда больше в вегетативных органах, чем в семенах, корнях и клубнях.
Из всех зольных элементов калий потребляется растениями в наибольшем количестве. Особенно много потребляют калия подсолнечник, гречиха, картофель, свекла, капуста и другие овощные культуры, из зерновых — гречиха. Меньше потребляют калия зерновые культуры — рожь, пшеница, ячмень, овес.
Хлористый калий (хлорид калия) - KCl - основное калийное удобрение во всем мире. Содержание оксида калия составляет до 60%. Сырьём для получения KCl служит природный сильвинит (смесь сильвина KCl с галитом NaCl), а также минерал карналлит KCl·MgCl2·6H2O. Метод разделения основан на различной растворимости хлористых солей металлов при повышении темᴨературы с 20 до 1000С – метод галургии. С повышением температуры растворимость хлорида калия резко возрастает. Флотационный метод заключается в разделении минералов измельченной руды на основе различной их способности удерживаться на границе раздела фаз в жидкой среде. По внешнему виду его кристаллы розовой или оранжевой окраски.
Поташ (углекислый калий, карбонат калия) - K2CO3. Поташ — одна из солей, известных людям ещё в древности. Обычно поташ загрязнён различными примесями, поэтому не имеет такого чисто-белого цвета, как измельчённый карбонат калия. До XX века в Европе поташ был одним из важнейших промышленных химических реагентов. Его получали путём водной экстракции из растительной золы, с дальнейшей очисткой до необходимого уровня. Поэтому золу можно использовать как удобрение. Производство было сосредоточено в местах, богатых лесом — кое-где в Европе, но, в основном, в России и Северной Америке. На производство поташа ещё Петр I в 1721 году установил монополию: «Нигде никому отнюдь поташа не делать и никому не продавать под страхом ссылки в вечную каторжную работу»
Поташ представляет собой бесцветные кристаллы, хорошо растворимые в воде. Зарегистрирован в качестве пищевой добавки Е501. Поташ является хорошим источником калия для культур, чувствительных к хлоридам, а также на кислых почвах, так как он частично их нейтрализует.
Карбонат калия получается путем электролиза хлорида калия, в результате чего образуется гидроксид калия, который, вступая в реакцию с углекислым газом, образует воду и карбонат калия:
2КСl + 2Н2О = Н2 + С12 + 2КОН
2KOH + CO2 = K2CO3 + H2O
Сернокислый калий (сульфат калия) - K2SO4. Ценнейшее удобрение, содержащее К2О до 48%. Удобрение представляет собой бесцветные кристаллы, хорошо растворимые в воде. Данное удобрение можно использовать абсолютно на любых почвенных грунтах, без опасения его негативного влияние на уровень урожайности. Применяется в первую очередь под культуры, чувствительные к хлору (картофель, табак, лён, виноград, цитрусовые и др.). Входит в состав природных калийных солей, например шёнита K2SO4·MgSO4·6H2O, из которых и добывается. Шёнит назван в честь немецкого горного мастера Шёне, открывшего минерал. Еще один способ производства сульфата калия сводится к обменному разложению хлорида калия и сульфата магния:
2MgSO4 + 2KCl = K2SO4∙MgSO4 + MgCl2
калимагнезия
K2SO4 * MgSO4 + 2KCl = 2K2SO4 + MgCl2
Кали-магнезия (сульфат калия магния, калимаг) K2SO4∙MgSO4 - серые кристаллы, легко растворимые в воде. Содержит 28-30% К в расчете на К2О. Обладает хорошей рассеиваемостью и малой гигроскопичностью. Слеживается лишь при длительном хранении. Можно смешивать со всеми удобрениями кроме мочевины. Применяют кали-магнезию как основное удобрение при посеве и в подкормках. Оно является одним из лучших удобрений для чувствительных к хлору культур. Особенно эффективно на легких (ᴨесчаных и субᴨесчаных) почвах под картофель, горох, люпин, клевер, гречиху, ягодные и плодовые растения. Получают из минералов и руд, содержащих калий и магний в сульфатной форме, а также кали-магнезия образуется как побочный продукт при производстве сернокислого калия.
Не нашли, что искали? Воспользуйтесь поиском: