
ТОР 5 статей:
Методические подходы к анализу финансового состояния предприятия
Проблема периодизации русской литературы ХХ века. Краткая характеристика второй половины ХХ века
Характеристика шлифовальных кругов и ее маркировка
Служебные части речи. Предлог. Союз. Частицы
КАТЕГОРИИ:
- Археология
- Архитектура
- Астрономия
- Аудит
- Биология
- Ботаника
- Бухгалтерский учёт
- Войное дело
- Генетика
- География
- Геология
- Дизайн
- Искусство
- История
- Кино
- Кулинария
- Культура
- Литература
- Математика
- Медицина
- Металлургия
- Мифология
- Музыка
- Психология
- Религия
- Спорт
- Строительство
- Техника
- Транспорт
- Туризм
- Усадьба
- Физика
- Фотография
- Химия
- Экология
- Электричество
- Электроника
- Энергетика
Газ молекуласының еркіндік дәрежесі
Газ молекуласының еркіндік дәрежесі деп молекуланың кеңістіктегі орнын анықтайтын тәуелсіз параметрлердің жиынтығын айтамыз. Егер кез-келген дене кеңістікте қозғалатын болса, онда осы қозғалысты тәуелсіз алты қозғалыстың жиынтығы түрінде қарастыруға болады: үш ілгерілемелі қозғалыстың (тікбұрышты координаталар жүйесінің осьтері бойымен), үш айналмалы қозғалыстың (дененің массалар центрі арқылы өтетін өзара перпендикуляр үш осьтің айналасында) жиынтығы.
Қалыпты жағдайда газ молекулаларының еркіндік дәрежесі:
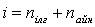
Жоғары температураларда бұл еркіндік дәрежесіне тербелмелі қозғалыстың бұл еркіндік дәрежесі қосылады.
Бір атомды газ үш бағытта ілгерілемелі қозғала алады. Сондықтан бір атомды газдың еркіндік дәрежесі 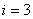 -ке тең.
-ке тең.
Екі атомды газ үш бағытта ілгерілемелі және екі бағытта айналмалы қозғала алады (сурет). Сондықтан екі атомды газдың еркіндік дәрежесі 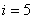 -ке тең болады.
-ке тең болады.
Үш атомды газ үш бағытта ілгерлемелі және үш бағытта айналмалы қозғала алады Сондықтан үш атомды газдың еркіндік дәрежесі 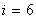 -ға тең болады.
-ға тең болады.
Максвелл таралуы
Ағылшын ғалымы Максвелл газ молекулаларының жылдамдық бойынша таралып орналасуын анықтайтын заңды ашты. Бұл заңдылық Максвелл таралуы деп аталды.
Максвелл ықтималдық теориясы мен математикалық статистика заңдылықтарын пайдалана отырып таралу функциясын алды.
Таралу функциясы 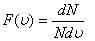 - дегеніміз жылдамдықтары модулі
- дегеніміз жылдамдықтары модулі 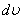 интервалы арасында жататын газ молекулаларының үлесі болып табылады.
интервалы арасында жататын газ молекулаларының үлесі болып табылады.
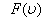 -функциясы газ молекулаларының жылдамдықтар бойынша таралып орналасу функциясы деп аталады. Өз кезегінде
-функциясы газ молекулаларының жылдамдықтар бойынша таралып орналасу функциясы деп аталады. Өз кезегінде 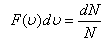 молекулалардың жылдамдықтарының модульдері
молекулалардың жылдамдықтарының модульдері 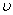 және
және 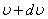 аралығында жату ықтималдылығын анықтайды.
аралығында жату ықтималдылығын анықтайды.
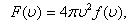
мұндағы: 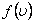 -таралу тығыздығы,
-таралу тығыздығы, 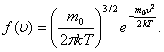
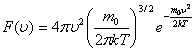 .
.
Жылдамдықтары 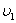 -ден
-ден 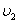 -ге дейінгі аралықта жататын молекулалар саны:
-ге дейінгі аралықта жататын молекулалар саны:
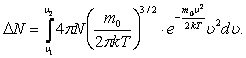
Газ молекулаларының жылдамдықтар бойынша таралу графигі келесі суретте көрсетілген.
мұндағы: Т1<Т2.
Газ температурасы артқан сайын графиктің максимумы үлкен жылдамдықтар жағына ығысады. Сондықтан газдарды қыздырғанда аз жылдамдықпен қозғалатын молекулалардың үлесі азаяды, ал үлкен жылдамдықпен қозғалатын молекулалардың үлесі артады.
Газдағы көпшілік молекулалар ықтимал жылдамдықтай жылдамдықпен қозғалады. 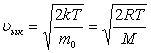 .
.
Молекулалардың орташа жылдамдығы - 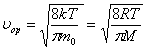 .
.
Молекулалардың орташа квадраттық жылдамдығы - 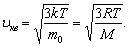
Яғни осы формулалардан 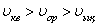 болатыны көрінеді.
болатыны көрінеді.
Больцман таралуы
Сыртқы күштер болмаған жағдайда термодинамикалық тепе-теңдік күйіндегі газ молекулаларының орташа концентрациясы бар жерде бірдей болады.
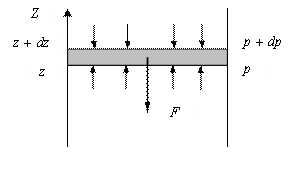
| Ал газ сыртқы өрісте орналасқан кезде молекулалардың таралып орналасуы өзгеше болады. Сыртқы потенциалды өрістегі газды қарастырамыз. Мысалы: ауырлық өрісіндегі ауаны. Газдың барлық қабаттарындағы температурасы бірдей деп есептейік. Сыртқы күш төмен, ал z осі жоғары бағытталсын. |
Газда ойша  қабатын бөліп аламыз (сурет). Осы
қабатын бөліп аламыз (сурет). Осы  қабатқа төменнен жоғары бағытталған
қабатқа төменнен жоғары бағытталған 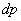 қысым айырмасының нәтижесінде пайда болған күш әсер етеді, ал жоғарыдан төмен қарай сыртқы өрістің F күші әсер етеді. Бөлініп алынған газ қабатының төменгі және жоғарғы қабатына әсер ететін
қысым айырмасының нәтижесінде пайда болған күш әсер етеді, ал жоғарыдан төмен қарай сыртқы өрістің F күші әсер етеді. Бөлініп алынған газ қабатының төменгі және жоғарғы қабатына әсер ететін 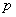 және
және 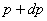 қысымдарының айырмасы
қысымдарының айырмасы 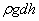 гидростатикалық қысымға тең болады:
гидростатикалық қысымға тең болады:
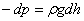 .
.
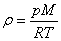 екенін ескере отырып, келесі өрнекті аламыз:
екенін ескере отырып, келесі өрнекті аламыз:
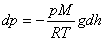 немесе
немесе 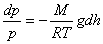 .
.
Осы өрнекті 0-ден h биіктікте және 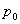 -ден
-ден 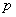 қысымға дейін интегралдап, алатынымыз:
қысымға дейін интегралдап, алатынымыз:
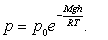
Барометрдің көмегімен 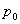 және
және 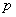 қысымдарын өлшеу арқылы биіктікті анықтауға болады:
қысымдарын өлшеу арқылы биіктікті анықтауға болады:
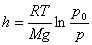 .
.
Бұл өрнек барометрлік формула деп аталады.
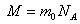 екенін ескерсек
екенін ескерсек
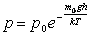 .
.
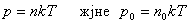 өрнектерін пайдаланып, жоғарыдағы өрнек келесі түрде жазылады:
өрнектерін пайдаланып, жоғарыдағы өрнек келесі түрде жазылады:
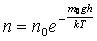 ,
,
мұндағы: 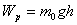 газ молекулаларының сыртқы өрістегі потенциалдық энергиясы болып табылады.
газ молекулаларының сыртқы өрістегі потенциалдық энергиясы болып табылады.
Сонда алынатын 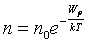 формуласы Больцман таралуының математикалық өрнегі болып табылады.
формуласы Больцман таралуының математикалық өрнегі болып табылады.
Биіктік артқан сайын потенциалды өрістегі молекулалардың концентрациясы экспоненталық заңмен кемиді.
§ 1.1 Молекулалық-кинетикалық теорияның негiзгi ұғымдары
Дене құрылымының молекулалық кинетикалық теориясы деп барлық денелер жеке бейберекет қозғалыстағы бөлшектерден тұрады деген көзқарас негiзiнде макроскоптық денелердiң қасиеттерi мен жылу процестерiне түсiнiк беретiн iлiмдi айтады.
§ 1.2 Молекуллар массасы мен өлшемi. Салыстырмалы молярлық және молекулалық масса. Авогадро саны.
Әртүрлi денелер молекуласының масса бiрлiгi ретiнде 12С көмiртегi изотобы атомының mocмассасының 1/12 бөлiгi алынады. Ол атомдық масса бiрлiгi (а.м.б.) деп аталады және мынаған тең...
§ 1.3 Молекулалар арасындағы өзара әсерлесу күштерi. Сұйық, газ тәрiздес және қатты денелердiң құрылымы
Молекулалар қозғалыс кезiнде бiр-бiрiмен өзара тартылыс және тебiлiс әсерiнде болады. 1.3 суретте молекулалық өзара әсерлесу күштерiнiң таралуы молекулалар арасындығы r арақашықтықтан тәуелдiлiгi келтiрiлген. Тартылу және тебiлу күштерi r-дан тәуелдiлiгi әртүрлi, сондықтан олардың қорытқы күшi нөлден өзгеше. Белгiлi бiр r = r0 арақашықтықта тебiлу күшi арасында тепе-теңдiк орнайды. Молекулалардың диаметрiмен салыстырылатын бұл арақашықтық тепе-теңдiк жағдайына сәйкес келедi. r < r0 болғанда тебiлу күшi тартылу күшiнен басым болады. Сондықтан молекулалар бiр-бiрiне ене алмайды. Олардың арасындағы арақашықтық r > r0 өскен сайын, молекулалардың тартылуы тебiлуiн жеңе бастaйды. Олардың ыршып кетуiне жол бермейдi. r >> r0 кезiнде, молекуларалық күштердiң әсерi болмайды.
§ 1.4 Газдың молекулалық-кинетикалық теориясының негiзгi теңдеуi
Идеал газ деп молекулалардың өзара әсерлесуi ескерусiз аз шама болғанда айтады. Молекулалардың өзара әсерлесуi олардың соқтығысуы кезiнде серпiмдi ұрылуы түрiнде байқалады.
§ 1.5 Газдың макропараметрлерi. Tемпература және оны өлшеу
Дененiң молекулалық-кинетикалық құрылымы ескерiлмегенде макроскоптық дене күйiн сипаттайтын шамаларды макроскоптық параметрлер деп атайды.
Бұндай шамалар қатарына көлем V, қысым P, температура T және басқалар. Көлем мен қысым механикалық сипатталатын шамалар. Температура дененiң қызу дәрежесiн бередi, оның iшкi энергетикалық күйiн анықтайды.
Егер қандайда бiр оқшауланған жүйенi құрайтын денелер температурасы бастапқы уақытта әртүрлi болса, онда уақыттың келесi мезеттерiнде олар бiртiндеп теңесе бастайды да ақырында бiрдей болады, денелер арасында жылулық тепе-теңдiк орнайды.
§ 1.6 Температура - идеал газ молекуласының орташа кинетикалық энергиясының өлшемi
Барлық газдар жылу тепе-теңдiгi кезiнде температуралары бiрдей болады. Молекулалардың жылулық қозғалысы сөз болғандықтан, температураны молекулалық деңгейдегi физикалық шамалар арқылы жазу керек. Бұндай шама ретiнде молекуланың iлгерлемелi қозғалысының кинетикалық энергиясын алуға болады. Бұл жорамал үш ыдыспен жасалған тәжiрибеде толық дәлелденедi.
§ 1.7 Газ молекуласының жылдамдығы. Штерн тәжiрибесi
Газ температурасы белгiлi болса, онда оның молекуласының қозғалысының орташа түзу сызықты жылдамдығын есептеуге болады. теңдеуiмен орташа кинетикалық энергия анықтамасынан теңдiгiмен теңестiрiп жылдамдықтың орташа квадраты үшiн келесi өрнектi аламыз:. Бұл шамадан алынған квадраттық түбiр орташа квадраттық жылдамдық деп аталады
§ 1.8 Больцман тұрақтысы. Клайперон-Менделеевтiң күй теңдеуi
Температура үшiн pV/N = kT түрiндегi формуланы практикада пайдалану пропорционалдық коэффициенттiң k сандық мәнiн бiлудi қажет етедi. Оны табуға болады, егер тәжiрибелерден белгiлi мәлiметтердi пайдаланса. Атап айтқанда, үш ыдыспен жасалған тәжiрибеден: V = 0.1м3 көлемдi алатын сутегiнiң бiр молi үшiн, θ= pV/N шамасы температураның T1=273oК мәнiнде мынаған тең θ0 = 3.76•10-21 Дж, ал T2=373oК болғанда – θ100 = 5.14•10-21 Дж. Температураның осы мәндерiндегi айырмасын θ= kT өрнегiн пайдаланып жазсақ, шығатыны θ100 – θ0 = k(Т2 – Т1) немесе (5.14 –3.76)•10-21 Дж = k•100o К. Бұдан
§ 1.9 Газдағы изопроцесстер және олардың графиктерi.
Параметрлерiнiң бiрiнiң шамасы өзгерiссiз өтетiн процестердi изопроцестер деп атайды. Газдың үшiншi параметрi тұрақты болған кездегi екi параметрi арасындағы мөлшерлiк байланысты (тәуелдiлiктi) газ заңдары деп атайды.
Параметрлердің біреуінің мәні өзгермей қалған кезде өтетін процестер изопроцестер деп аталады. Изопроцестер табиғатта кеңтаралған және техникада жиі пайдаланылады.
Шынында да, ешбір процесс қандай да болмасын қатаң тығайындалған бір параметрдің мәнінде жүрмейді. Температураның, қысымның немесе көлемнің тұрақтылығын бұзуға әсер ететін қандай да бір жағдайлар болады. Тек лабораториялық жағдайларда ғана қайсыбір параметрлердің тұрақтылығын тым дәлірек сақтауға болады, бірақ жұмыс істейтін техникалық құрылғыларда және табиғатта бұл іс жүзінде мүмкін емес. Изопроцесс - бұл нақты процестің идеалдандырылған моделі. Ол шындықты тек жуық қана бейнелейді.
Изотермиялық процесс[өңдеу]
Температура тұрақты болғанда макроскопиялық денелердің термодинамикалық жүйесі күйінің өзгеру процесін изотермиялық деп атайды. Газ температурасын тұрақты етіп ұстау үшін ол температурасы тұрақты болып тұратын үлке жүйемен - термостатпен - жылу алмасатындай болу керек. Өйткені сығылғанда немесе ұлғайғанда газдың температурасы өзгеретін болады. Егер атмосфералық ауаның бүкіл процес барысында елеулі өзгермесе, онда ол термостат қызметін атқара алады.
Идеал газ күйінің теңдеуіне сәйкес тұрақты температурадағы кез келген күйде газ қысымының оның көлеміне көбейтіндісіне тұрақты болады, яғни T = const
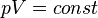 .
.
Егер газдың температурасы өзгермесе, онда оның берілген массасы үшін газ қысымының көлемге көбейтіндісі тұрақты болады.
Бұл заңды тәжірибие жүзінде ағылшын ғалымы Р. Бойль, одан біраз кейінірек француз ғалымы Э. Мариотт ашты. Сондықтан ол Бойль - Мариотт заңы деп аталады. Бойль - Мариотт заңы кез келген газ үшін, сондай-ақ олардың қоспасы үшін де, мысалы, ауа үшін де дұрыс. Тек атмосфералық қысымнан бірнеше жүз есе жоғары қысымдарда ғана бұл заңның ауытқуы елеулі байқалады. Тұрақты температурада газ қысымының көлемге тәуелділігі график түрінде изотерма деп аталатын қисық сызық арқылы кескінделеді. Газдың изотермасы қысым мен көлемнің арасындағы кері пропорционал тәуелділікті өрнектейді. Қисық сызықмұндай түрін математикада гипербола деп атайды. Әр түрлі тұрақты температураға әр түрлі изотермалар сәйкес келеді. Егер V = const болса, температура жоғарлағанда қысым күй теңдеуіне сәйкес артады. Сондықтан жоғарлау Т2 температураға сәйкес изотерма, төменірек Т1 температураға сәйкес келетін изотермадан жоғары жатады. Компрессормен ауны сығу процесін немесе ыдыстағы ауаны соырп, шығарғанда поршень астындағы ауаның ұлғаюын - шамамен изотермиялық процесс деп есептеуге болады. Шынында, бұл жағдайда температура өзгеретіні рас, алайда алғашқы жуықтауда ондай өзгерісті елемеуге болады.
Изобаралық процесс.[өңдеу]
Қысым тұрақты болғанда термодинамикалық жүйе күйінің өзгеру процесі изобаралық деп аталады. 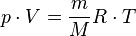 теңдеуіне сәйкес, қысымы өзгерсе газдың кез келгенкүйінде көлемнің температураға қатынасы тұрақты болады:
теңдеуіне сәйкес, қысымы өзгерсе газдың кез келгенкүйінде көлемнің температураға қатынасы тұрақты болады:
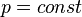 болғанда,
болғанда, 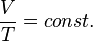
Не нашли, что искали? Воспользуйтесь поиском: